
 .
.分析 ①以体心立方堆积形成的金属铁,结构基元为2,两个原子坐标为(0,0,0),($\frac{1}{2},\frac{1}{2},\frac{1}{2}$),以体心粒子看,周围等径且最近的粒子数为8个顶点的粒子;
②求等电子体通常采用的方法是上下左右平移元素,同时调控电子数得到;
③六氰合亚铁离子[Fe(CN)6]4-,是配离子,配体为CN-,据此分析其中的价键类型.
解答 解:①以体心立方堆积形成的金属铁,内部只有两个原子,以体心粒子看,周围等径且最近的粒子数为8个顶点的粒子,因此配位数为8,
故答案为:8;
②等电子体是指原子数相同,价电子数相同的粒子,与CN-互为等电子体的单质有N2,电子式为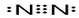 ,
,
故答案为: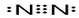 ;
;
③[Fe(CN)6]4-,是配离子,配体为CN-,含有共价键,配位键,CN-中为C≡N-,其中含有一根σ键和2根π键,综上,不含有非极性键,
故选B.
点评 本题考察物质的结构基本知识,包含晶胞,等电子体原理,电子式的书写,配合物的知识,价键类型的判断.本题难度不大,是基础题.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁电池放电时,Mg2+向负极移动 | |
| B. | 镁电池充电时,阳极发生的反应为:Mo3S42x--2xe-=Mo3S4 | |
| C. | 锂离子电池放电时,负极的电极反应式为 LixC6+xe-=xLi++C6 | |
| D. | 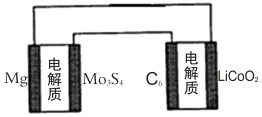 用镁电池给车载锂离子电池充电时连接方式如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
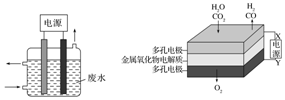 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水一种试剂可将苯、四氯化碳、己烯、乙醇、苯酚鉴别开 | |
| B. | 组成为 C4H10O 的醇与乙二酸可生成 10 种二元酯 | |
| C. | 含四个碳原子的有机物,氢原子个数一定为 10 个 | |
| D. | 芥子醇(如图)分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该高分子由4种单体(聚合成髙分子的简单小分子)缩聚而成 | |
| B. | 构成该分子的几种竣酸单体互为同系物 | |
| C. | 上述单体中的乙二醇,可被02催化氧化生成单体之一的草酸 | |
| D. | 该高分子有固定熔沸点,1 mol上述链节完全水解需要氢氧化钠物质的量为 5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.
实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com