氨是最重要的化工产品之一.
(1)合成氨用的氢气可以用甲烷为原料制得:CH
4(g)+H
2O(g)═CO(g)+3H
2(g).已知:
①CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H=-846.3kJ?mol
-1②CO
2(g)═CO(g)+
O
2(g)△H=+282.O kJ?mol
-1③
O
2(g)+H
2(g)═H
2O(g)△H=-241.O kJ?mol
-1则消耗1molCH
4吸热
.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:
[Cu(NH
3)
2CH
3COO](l)+CO(g)+NH
3(g)?[Cu(NH
3)
3]CH
3COO?CO(l)△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是
.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)将净化后的气体充入一体积不变的密闭容器中,发生反应:N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ?mol
-1.达到平衡后,能加快反应速率且提高H
2转化率的措施有
A.升高温度 B.增加N
2的用量 C.将NH
3液化 D.充入Ne
(4)用氨气制取尿素[CO(NH
2)
2]的反应为:
2NH
3(g)+CO
2(g)?CO(NH
2)
2(s)+H
2O(g)△H<0
某温度下,向容积为1L的密闭容器中通入4mol NH
3和2mol CO
2,该反应进行到40s时达到平衡,此时CO
2的转化率为50%.
①该温度下此反应平衡常数K的值为
.此时若再向容器内充入2mol NH
3、1mol CO
2、1mol CO(NH
2)
2、1mol H
2O(g),则反应
(填“正向移动”、“逆向移动”或“处于平衡状态”)
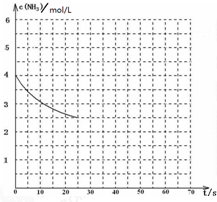
②图中的曲线表示该反应在前25s内的反应进程中的NH
3浓度变化,则25s内用CO
2表示的反应速率为
mol?L
-1?s
-1.
③若保持其它条件不变,请在图中用实线画出使用催化剂时NH
3浓度变化曲线.
(5)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3?H2O |
| 电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Kb=1.77×10-5 |
现有常温下0.1mol?L
-1的(NH
4)
2CO
3溶液,你认为该溶液呈
性(填“酸”、“中”、“碱”),原因是
.



 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.