
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
分析 设1mol S(s)转化为S(g)时吸收的能量为x,在反应S(s)+3F2(g)═SF6(g)中,若生成1mol SF6(g)时,放出1220kJ的能量,则该反应△H=反应物总键能-生成物总键能=-1220kJ/mol列式计算.
解答 解:设1mol S(s)转化为S(g)时吸收的能量为x,
在反应S(s)+3F2(g)═SF6(g)中,若生成1mol SF6(g)时,放出1220kJ的能量,则该反应的焓变△H=x+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,
解得:x=280 kJ,
故选D.
点评 本题考查反应热与焓变的应用,题目难度中等,明确焓变与反应物、生成物键能的关系为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
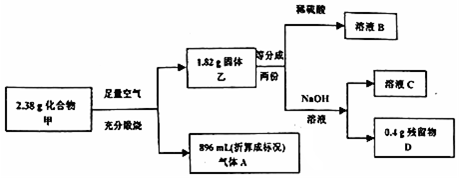
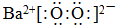 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型为酯化反应.
,反应类型为酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
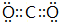 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物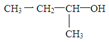 的名称为2-丁醇 的名称为2-丁醇 | |
| B. | 蛋白质、淀粉、纤维素都是高分子化合物 | |
| C. | 合成有机物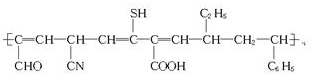 使用的单体有3种 使用的单体有3种 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 780 | 1300 | 2100 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素X的常见化合价是+1 | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 元素X与氯形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体 | HA放出氢气的反应速率更快 | 酸性:HB<HA |
| B | 以铜、铁、浓硝酸构成原电池 | 铁表面有红棕色气泡产生 | 铜作原电池的负极 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCls饱和溶液 | 前者为黄色,后者为红褐色 | 升高温度,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中 | 一段时间后,检验固体主要成分为CaCO3 | Ksp ( CaSO4)<Ksp ( CaCO3 ) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com