
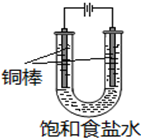
 CuCl��Ӧ�ù㷺���л��ϳɴ������ɲ�ȡ��ͬ������ȡ��
CuCl��Ӧ�ù㷺���л��ϳɴ������ɲ�ȡ��ͬ������ȡ������ ����һ��CuSO4��Һ��NaCl��Cu�ۡ������ڼ���������Ӧ�õ�[CuCl3]2-�����˷����δ��Ӧ��Cu����Һ�к���CuCl3]2-����ˮ��Һ�д���ƽ�⣺CuCl����ɫ��+2Cl-?[CuCl3]2-����ɫ��Һ��������ˮ����ϡ�ͣ�������CuCl���������ɣ��پ������˷��룬ϴ�Ӹ���õ�CuCl��
��1������Ŀ��Ϣ��֪��Cu�����������ᷴӦ��������ͭ��ˮ��
��2�����ȿ��Լӿ췴Ӧ���ʣ���������ͭ��ҺΪ��ɫ����[CuCl3]2-Ϊ��ɫ��Һ��������Һ��ɫ�仯�жϷ�Ӧ�Ѿ���ȫ��
��3����ʪ��CuCl�ڿ���������ˮ�����������ʼ�����Ũ���ἰ�þƾ�ϴ�Ӿ���������ˮ�⣬������и������������Ӵ���
����������4�����õ��ԭ���Ʊ�CuCl����������������Ӧ��Cuʧȥ���ӣ�����������������CuCl��
��� �⣺����һ��CuSO4��Һ��NaCl��Cu�ۡ������ڼ���������Ӧ�õ�[CuCl3]2-�����˷����δ��Ӧ��Cu����Һ�к���CuCl3]2-����ˮ��Һ�д���ƽ�⣺CuCl����ɫ��+2Cl-?[CuCl3]2-����ɫ��Һ��������ˮ����ϡ�ͣ�������CuCl���������ɣ��پ������˷��룬ϴ�Ӹ���õ�CuCl��
��1������Ŀ��Ϣ��֪��Cu�����������ᷴӦ��������ͭ��ˮ����Ӧ���ӷ���ʽΪ��2Cu+O2+4H+$\frac{\underline{\;\;��\;\;}}{\;}$2Cu2++2H2O��
�ʴ�Ϊ��2Cu+O2+4H+$\frac{\underline{\;\;��\;\;}}{\;}$2Cu2++2H2O��
��2�������¶ȣ���Ӧ���ʼӿ죬���С����ȡ���Ŀ���ǣ��ӿ췴Ӧ�����ʣ���������ͭ��ҺΪ��ɫ����[CuCl3]2-Ϊ��ɫ��Һ�����۲쵽��Һ����ɫ��Ϊ��ɫ����������Ӧ�Ѿ���ȫ��
�ʴ�Ϊ���ӿ췴Ӧ�����ʣ���Һ����ɫ��Ϊ��ɫ��
��3����ʪ��CuCl�ڿ���������ˮ�����������ʼ�����Ũ���ἰ�þƾ�ϴ�Ӿ���������ˮ�⣬������и������������Ӵ�����ֹ������
�ʴ�Ϊ��Ũ���ᡢ95%�Ҵ�����ո��
����������4�����õ��ԭ���Ʊ�CuCl����������������Ӧ��Cuʧȥ���ӣ�����������������CuCl�������ĵ缫��ӦʽΪ��Cu-e-+Cl-=CuCl��
�ʴ�Ϊ��Cu-e-+Cl-=CuCl��
���� ���⿼��ʵ���Ʊ��������漰�Թ������̵����⡢�Բ������Լ��ķ������ۡ�ƽ���ƶ������ԭ�����ܶȻ�Ӧ�õȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�80 g SO3��ռ�����ԼΪ22.4 L | |
| B�� | ���³�ѹ�£�1.6 gO2��O3�����������������Ϊ0.8NA | |
| C�� | 0.1 mol����-CH3������������ΪNA | |
| D�� | ������״̬�£�1 mol NaHSO4��ȫ���������������ĿΪ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
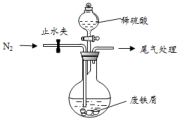 ҽ�����̷���FeSO4•7H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
ҽ�����̷���FeSO4•7H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
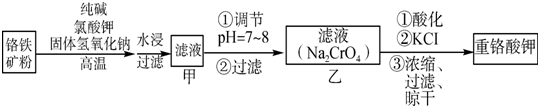
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
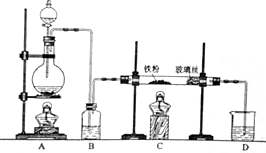 ij�о���ѧϰС��ģ�ҵ�������̽������飮��ش��������⣺
ij�о���ѧϰС��ģ�ҵ�������̽������飮��ش��������⣺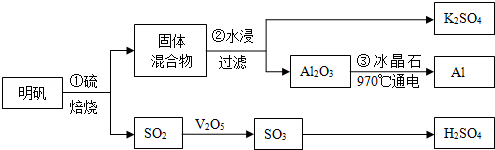
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
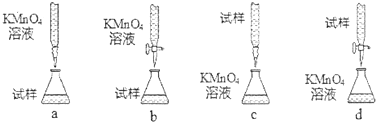
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
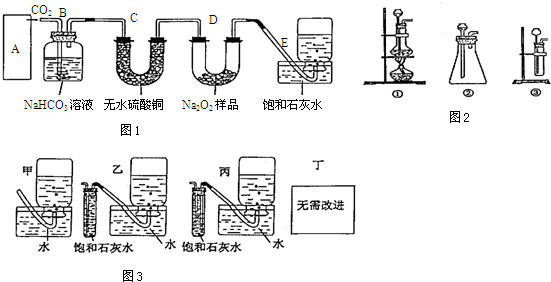
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
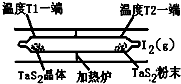 ��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã�
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com