
| A. | 全部 | B. | ①②③⑤ | C. | ①②③ | D. | ①②③④ |
分析 a.对于共价化合物,元素化合价的绝对值+该元素原子核外电子数=8,该原子满足8电子结构;
b.单质分子通过电子式判断,共用电子对数+原子最外层电子数=8;
c.对于离子化合物,对于阴离子,元素化合价的绝对值+该元素原子核外电子数=8,该原子满足8电子结构.对于阳离子根据核外电子排布规律,书写核外电子排布式判断,以此来解答.
解答 解:①N2中氧原子之间形成3对共用电子对,共用电子对数+原子最外层电子数=8,N原子满足8电子的结构,故正确;
②Cl2中Cl原子之间形成1对共用电子对,共用电子对数+原子最外层电子数=8,Cl原子满足8电子的结构,故正确;
③CO2中C元素的化合价为+4,C原子核外电子数为4,所以4+4=8,C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,O原子满足8电子结构,故正确;
④PCl5中P元素的化合价是+5价,P原子核外有5个电子,所以5+5=10,P原子不满足8电子结构,氯原子的化合价是-1,其化合价的绝对值是1,则1+7=8,所以Cl原子满足8的结构,故错误;
⑤H2O中H原子化合价是+1,H原子核外有1个电子,所以1+1=2,所以H原子不满足8电子,故错误;
故选C.
点评 本题考查8电子结构的判断,为高频考点,注意对于共价化合物元素化合价的绝对值+该元素原子核外电子数=8,该原子原子满足8电子结构是关键.注意阳离子的最外层电子数的判断,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化 | |
| B. | 晶体中共价键的键长:金刚石中C-C<石墨中C-C | |
| C. | 晶体的熔点:金刚石<石墨 | |
| D. | 晶体中共价键的键角:金刚石>石墨. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是伴随能量变化的都是化学变化 | |
| C. | 凡是放热反应都需要加热 | |
| D. | 凡是放热反应都不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含共用电子对数为($\frac{a}{7}+1$)NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此元素有三种同位素 | |
| B. | 其中质量数为79的同位素原子占原子总数 $\frac{1}{2}$ | |
| C. | 其中一种同位素质量数为80 | |
| D. | 此元素单质的平均相对分子质量为160 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
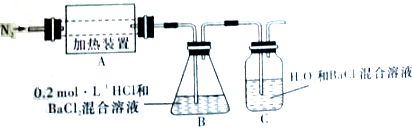
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
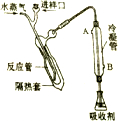 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: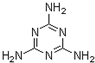 )
) 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com