
| A. | Al、Mg、Na | B. | Mg、Al、Na | C. | Na、Mg、Al | D. | Na、Al、Mg |
分析 等质量的Na、Mg、Al的物质的量之比=$\frac{1}{23}$:$\frac{1}{24}$:$\frac{1}{27}$,这三种金属分别与足量稀盐酸反应生成氢气,根据转移电子相等计算生成氢气物质的量大小,由m=nM计算生成氢气质量大小.
解答 解:等质量的Na、Mg、Al的物质的量之比=$\frac{1}{23}$:$\frac{1}{24}$:$\frac{1}{27}$,这三种金属分别与足量稀盐酸反应生成氢气,则这三种金属转移电子物质的量之比=$\frac{1}{23}$:$\frac{1×2}{24}$:$\frac{1×3}{27}$,根据每个方程式中转移电子相等得生成氢气物质的量之比=$\frac{\frac{1}{23}}{2}$:$\frac{\frac{1×2}{24}}{2}$:$\frac{\frac{1×3}{27}}{2}$=$\frac{1}{23}$:$\frac{1}{12}$:$\frac{1}{9}$,分子相同时分母越大比值越小,所以生成氢气物质的量大小顺序是Al、Mg、Na,根据m=nM知,生成氢气质量大小顺序是Al、Mg、Na,故选A.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量关系是解本题关键,根据转移电子守恒进行计算,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 | |
| B. | 若铁钉完全溶解,则滤液中一定含CuSO4 | |
| C. | 若铁钉表面有红色物质生成,则不溶物中一定不含Fe | |
| D. | 若铁钉无变化,则不溶物中一定含Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L NH4Cl溶液 | B. | 0.5mol/L盐酸 | ||
| C. | 0.5mol/LH2SO4 | D. | 0.5mol/L醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
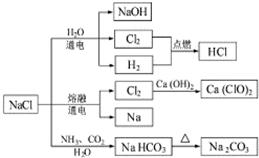 NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的小 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下液氯能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
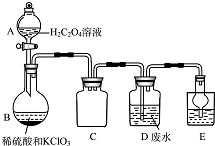 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液加入盐酸,有无色无味气体产生 | 溶液一定含有CO32- |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液一定含Fe2+ |
| C | 向某溶液滴加浓NaOH溶液加热,有能使湿润的红色石蕊试纸变蓝的气体产生 | 溶液一定存在NH4+ |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管中有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com