
短周期元素X、Y、Z、M的原子序数依次增大。元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下,M单质为淡黄色固体。下列说法不正确的是
A. X单质与M单质不能直接化合
B. Y的合金可用作航空航天飞行器材料
C. M简单离子半径大于Y2+的半径
D. X和Z的气态氢化物,前者更稳定
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:填空题
己知H元素有多种同位素。
(1)有H、D (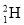 )、T(
)、T(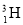 )三种原子,各自可形成双原子分子H2、D2、T2。
)三种原子,各自可形成双原子分子H2、D2、T2。
①标准状况下,它们的密度之比为___________。
②相同物质的量的三种单质中,质子数之比为______________。
③同温同压下,1L各单质气体中所含电子数之比为__________。
(2)36gH2O与80gD2O的物质的量之比是__________,它们分別与Na反应时,所放出气体体积之比(同条件)是__________,质量之比是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分.
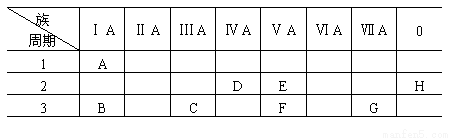
(1)写出元素符号: A________、F________。
(2)根据A~H元素在周期表中的位置,选适当的化学式或方程式填入空白处。
①单质中氧化性最强的是________,还原性最强的是________。
②最高价氧化物对应水化物碱性最强的是________,气态氢化物水溶液酸性最强的是_______。
③写出C的单质与B的最高价氧化物水化物溶液反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
雾霾严重地威胁着人们生命生存的生态环境。下列有关措施不可行的是( )
A. 对燃煤进行脱硫,减少向大气排放SO2
B. 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
C. 为增加工业产值,大力兴建水泥厂、炼钢厂
D. 对汽车等交通工具采用清洁燃料,如天然气、甲醇等
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:简答题
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
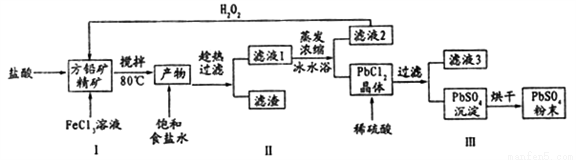
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
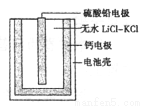
①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:填空题
重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
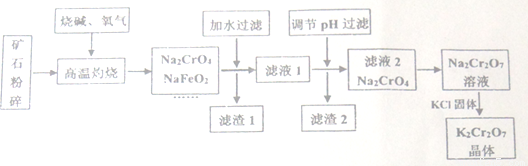
已知:①NaFeO2遇水强烈水解②2CrO42-(黄色) + 2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
请回答下列问题:
(1)将矿石粉碎的目的是________;高温灼烧时Cr2O3发生反应的化学方程式为__________。
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式________。滤渣2的主要成分是A1(OH)3和______________。
(3)用简要的文字说明Na2Cr2O7溶液中加入KC1固体,降温析出K2Cr2O7的原因_______。
(4) 25°C时,对反应2CrO42-(黄色)+2H+ Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
时间/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol·L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
(Cr2O72-)/ (mol·L-1) | 0 | 9.2×l0-2 | 9.4×10-2 | 9.5×10-2 |
反应达到平衡时,溶液的pH=l,该反应平衡常数K为______。
②下列有关说法正确的_____________。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03 s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2 : 1时该反应己达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为
A. NaHCO3、Al(OH)3 B. AgCl、NaHCO3
C. BaCO3、Na2SO3 D. CuSO4、Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y组成的化合物X2Y,那么X、Y所在主族序数可能是( )
A. ⅡA和ⅦA B. ⅤA和ⅥA C. ⅥA和ⅥA D. ⅠA和ⅥA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com