
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,A是生活中用量最大的金属。
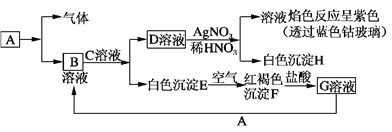
试回答:
(1)写出C的化学式________,H的化学式________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中的金属阳离子的方法是________________________________。
(4)写出A在一定条件下与水反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
【答案】 产生白色沉淀 白色沉淀消失 2Na + 2H2O ![]() 2Na++ 2OH- + H2↑ 水或H2O 2 NaNO2 碘(或I) 0.5 mol
2Na++ 2OH- + H2↑ 水或H2O 2 NaNO2 碘(或I) 0.5 mol
【解析】(1)向AlCl3溶液中,滴加少量NaOH溶液,发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,现象是产生白色沉淀;继续滴加NaOH溶液至过量,发生反应Al(OH)3+NaOH═NaAlO2+2H2O,现象是白色沉淀消失;(2)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na + 2H2O ![]() 2Na++ 2OH- + H2↑,反应中水中H元素化合价由+1价降低为0价,水是氧化剂,生成1molH2时转移电子的物质的量为1mol×2=2mol;(3)①反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O中,元素化合价的变化分别如下:氮元素:NaNO2 →NO,由+3价→+2价,得电子,所以NaNO2是氧化剂;碘元素,HI→I2,由-1价→0价,失电子,被氧化的是碘元素;②根据反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为0.5 mol。
2Na++ 2OH- + H2↑,反应中水中H元素化合价由+1价降低为0价,水是氧化剂,生成1molH2时转移电子的物质的量为1mol×2=2mol;(3)①反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O中,元素化合价的变化分别如下:氮元素:NaNO2 →NO,由+3价→+2价,得电子,所以NaNO2是氧化剂;碘元素,HI→I2,由-1价→0价,失电子,被氧化的是碘元素;②根据反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为0.5 mol。
【题型】综合题
【结束】
19
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝克;
(2)当加入ml氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。则混合气体中CH4、C2H6、C3H8、的体积比不可能是: ( )
A. 2∶1∶2 B. 2∶3∶1 C. 1∶4∶1 D. 5∶3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图: 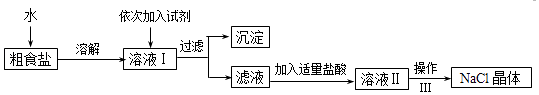
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)从上述提供的试剂中选出适当的试剂除去溶液I中的Ca2+、Mg2+、SO42﹣离子,滴加顺序依次为、、(只填化学式).
(2)操作Ⅲ的名称是 , 所需用到的仪器主要有铁架台、酒精灯、铁圈、(填仪器名称).
(3)加盐酸的目的是(用离子方程式表示)、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用溶解、过滤、结晶的方法来分离的一组物质是
A. NaCl和Na2SO4 B. CuO和KCl C. BaSO4和CaCO3 D. NaNO3和NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com