
向10mL 0.1mol•L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是()
A. x=10时,溶液中有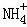 、Al3+、
、Al3+、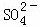 ,且c(
,且c(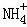 )=c(Al3+)
)=c(Al3+)
B. x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C. x=30时,溶液中有Ba2+、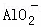 、OH﹣,且c(OH﹣)>c(
、OH﹣,且c(OH﹣)>c(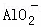 )
)
D. 滴加过程中,生成沉淀的最大物质的量为0.003mol
考点: 离子方程式的有关计算.
专题: 离子反应专题.
分析: 当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH﹣量不足,OH﹣先与Al3+反应,与NH4+不反应,所以溶液中有没有参加反应的NH4+和部分剩余的Al3+存在,同时SO42﹣也有剩余,但此时不会有AlO2﹣生成,结合铵根离子水解解答;当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol NaAlO2、0.001 mol NH3•H2O,且剩余0.001 mol Ba2+和0.001 mol OH﹣,由于NH3•H2O也是一种碱,存在电离平衡:NH3•H2O⇌NH4++OH﹣,据此判断反应中c(OH﹣)与c(AlO2﹣)、c(Ba2+)的大小关系.
解答: 解:A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH﹣量不足,OH﹣首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42﹣也有剩余,但此时不会有AlO2﹣生成,溶液中c(NH4+)>c(Al3+),故A错误;
B、x=20时,溶液中所发生的反应离子方程式为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3•H2O,故B错误;
C、当x=30时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42﹣,30ml等浓度Ba(OH)2溶液有0.003molBa2+,6mmolOH﹣,混合后硫酸钡沉淀,剩余0.001molBa2+;OH﹣过量溶液中存在0.001moAlO2﹣,铵根离子和氢氧根离子反应生成一水合氨,氢氧根离子剩余0.001mol;一水合氨电离生成铵根离子和氢氧根离子,此时c(OH﹣)>c(AlO2﹣),故C正确;
D、滴加过程中,生成沉淀的最大物质的量为氢氧化铝和硫酸钡沉淀,当 NH4Al(SO4)2溶液和Ba(OH)2溶液按照物质的量之比是1:2混合,沉淀的量最大,为0.002mol硫酸钡和0.001mol氢氧化铝,即沉淀的最大量是0.003mol,故D正确.
故选CD.
点评: 本题考查了离子方程式的书写原则和方法应用,主要是定量反应的产物判断,关键分析离子反应顺序,先沉淀后反应生成弱电解质后沉淀溶解.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
实验室里需用480mL 0.1mol•L﹣1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是()
A. 称取7.68g硫酸铜,加入500mL水
B. 称取12.0g胆矾配成500mL溶液
C. 称取8.0g硫酸铜,加入500mL水
D. 称取12.5g胆矾配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 H+NH4+Al3+K+
可能大量含有的阴离子 Cl﹣Br﹣I‑ClO‑AlO2﹣
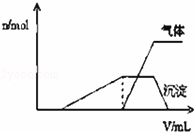
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有K+,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积
(标准状况) 2.8L 5.6L 11.2L
n(Cl﹣) 1.25mol 1.5mol 2mol
 n(Br﹣) 1.5mol 1.4mol 0.9mol
n(Br﹣) 1.5mol 1.4mol 0.9mol
n(I﹣) a mol 0 0
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①H2(g)+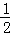 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+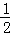 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+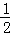 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4 H6O5),广泛存在于许多水果中,是一种常用的食品添加剂.该化合物具有如下性质:
i.25℃时,电离常数K1=3.99×10﹣4,K2=5.5×10﹣6
ii.Imol A与足量钠产生1.5mol H2;
ii.分子中核磁共振氢谱显示有5种不同化学环境的氢原子.与A相关的反应流程如下:
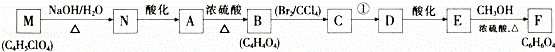
回答下列问题:
(1)A中官能团的名称为 ;B的结构简式为 ,C的系统命名为 _.
(2)A﹣﹣B的反应类型为消去反应;反应①所需的反应条件为 .
(3)写出下列反应的化学方程式:
①M﹣N. ;
②E﹣F. ,
(4)A有多种同分异构体,写出符合下列条件的同分异构体结构简式: .
①能发生水解,生成两种有机物;②水解后产物之间能发生缩聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L﹣1.对此反应速率的表示正确的是()
A. 用A表示的反应速率是0.4mol•L﹣1•min﹣1
B. 分别用B、C、D表示反应速率,其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol•L﹣1•min﹣1
D. 在2min内的反应速率,用C表示是0.3mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,同时加水稀释到50mL,此时X和盐酸缓慢反应.其中反应速率最大的是()
A. 10℃20mL3mol/L的X溶液 B. 20℃30mL2mol/L的X溶液
C. 20℃10mL4mol/L的X溶液 D. 10℃10mL2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com