
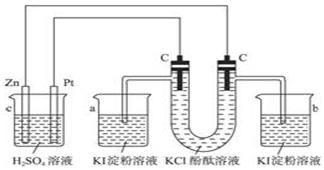
分析 左装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,右装置为电解池,左边c为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、右边c为阴极,阴极反应式为2H2O+2e-=H2↑+2OH-,a中发生反应2KI+Cl2═2KCl+I2,碘遇淀粉试液变蓝色,b中有无色气体生成,淀粉碘化钾溶液不变色,据此分析解答.
解答 解:(1)左装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极,右装置为电解池,C(连Zn)为阴极,故答案为:负极;阴极;
(2)左装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,阳极上氯离子放电生成黄绿色气体,阴极上生成无色氢气且溶液呈碱性,碱遇酚酞试液变红色,所以U型管中看到的现象是:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色,
故答案为:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色;2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑;
(3)如果小烧杯中有0.508g碘析出,析出碘的物质的量=$\frac{0.508g}{254g/mol}$=0.002mol,转移电子的物质的量=2×0.002mol=0.004mol,串联电路中转移电子相等,所以消耗Zn的质量=$\frac{0.004mol}{2}$×65g/molg=0.13g,
故答案为:0.13g.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,同时考查学生分析问题、解答问题能力,知道常见物质的性质,注意串联电路中转移电子相等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向滴有酚酞的NaOH溶液中通入 Cl2 | 溶液褪色 | HClO有漂白性 |
| B | 无水乙醇与浓硫酸共热至170℃,将产生气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色深 | 结合H+能力: CO32->HCO3- |
| D | 用发光小灯泡分别做HCl和CH3COOH导电性实验 | 发光强度:HCl强于CH3COOH | CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Cl-,一定没有HCO3-和SO42- | |
| B. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ | |
| C. | 肯定有Al3+、NH4+、Cl-,肯定没有HCO3- | |
| D. | 该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
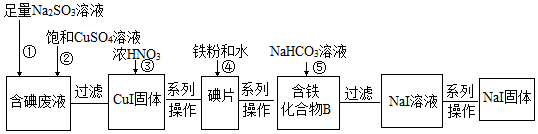
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质 | |
| B. | 水溶液中,1 mol KCl比1 mol KClO3电离出的Cl-多 | |
| C. | NH3溶于水后,溶液能够导电,但NH3是非电解质 | |
| D. | NaHSO4溶于水电离方程式为NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 10:1 | C. | 9:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水的消毒 | |
| B. | 氯气制漂白粉时发生的是氧化还原反应 | |
| C. | 氯气可以使湿润的有色布条褪色 | |
| D. | 铁在氯气中燃烧生成氯化亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯盐酸 | 淀粉溶液 | 硫酸 | 液氨 |
| B | 漂粉精 | 水玻璃 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 碳酸钠 | 乙醇 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
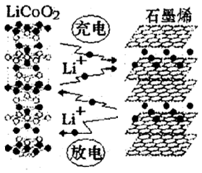 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )| A. | 该电池若用隔膜可选用质子交换膜 | |
| B. | 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 石墨烯电池的优点是提高电池的储铿容量进而提高能量密度 | |
| D. | 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com