
2-萘甲醚是粉红色固体,熔点约73℃,可用两种方法制备。
1.制备2-萘甲醚的传统方法是用2-萘酚与硫酸二甲酯在碱性催化下反应制备(水浴加热),写出反应方程式。
2.制备2-萘甲醚的新方法是以三氯化铁作为催化剂,在微波照射下,用酚与醇反应生成,写出反应方程式。
3.新方法的产率为59%,如何将产物从反应体系中分离?
4.新方法比传统方法有很多优点,如:①缩短了反应时间,传统方法要2h,新方法只要15min;②……请再列举2个优点。
1.2![]() +(CH3O)2SO2+2NaOH
+(CH3O)2SO2+2NaOH![]() 2
2![]() +Na2SO4+2H2O
+Na2SO4+2H2O
(2分)
2.![]() +CH3OH
+CH3OH![]()
![]() +H2O(2分)
+H2O(2分)
3.反应结束后,加入少量水,用10mL无水乙醚分两次萃取,再用10%氢氧化钠和水洗涤醚层,醚层经干燥后在水浴上蒸去乙醚,再冷却析出固体。(2分)
4.②新方法中反应物用了甲醇,催化剂是少量的三氯化铁,副产物是对环境无害的水。整个反应没有涉及到对环境有害的物质;传统方法中反应物还有硫酸二甲酯和氢氧化钠这两种对环境有害的物质,其中硫酸二甲酯毒性很强,而氢氧化钠是强腐蚀性的。
③新方法中反应物的原子除了很少一部分转化成水分子,其他的都转化为产物2-萘甲醚,是一个“原子经济”反应。
④从反应成本看:新方法的另一个反应物是价格低廉的甲醇;而传统方法中还用到硫酸二甲酯和氢氧化钠,成本相对较高。(任答2点,各1分)


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
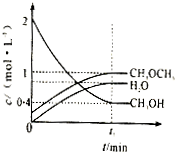 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com