
下列物质的性质与应用对应关系正确的是
A.FeCl3溶液显酸性,可用于蚀刻印刷电路板
B.Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙
C.MgO、Al2O3熔点高,可用于制作耐高温坩埚
D.Na、K合金具有强还原性,可用于原子反应堆的导热剂
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
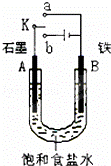
某课外活动小组同学用如图装置进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为 .有关该实验,下列说法正确的是(填序号) .
①A为正极,B为负极
②电子由电极B流出经溶液流向A极
③溶液中Na+向A极移动
④该反应相当于在模拟钢铁的析氢腐蚀
(2)若开关K与b连接,则可模拟工业上离子交换膜法制烧碱,该电池的总反应可表示为(离子方程式) .
有关该实验,下列说法正确的是(填序号) .
①B为阴极,发生氧化反应
②A极电极反应式可表示为2Cl﹣=Cl2↑+2e﹣
③溶液中Na+向A极移动
④若标准状况下B极产生2.24L气体,则电路中通过的电子数为0.2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
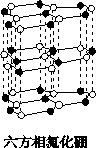
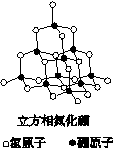
关于这两种晶体的说法,正确的是
| A.立方相氮化硼含有σ键和π键,所以硬度大 | B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中的既有极性键又有非极性键 | D.两种晶体均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
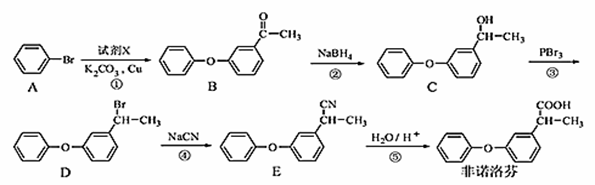
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)化合物A的分子式为 。
(3)反应④的反应类型是 。
(4)化合物D与NaOH醇溶液反应的方程式 。
(5)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中含有两个苯环,且分子中有6种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(6)利用类似上述非诺洛芬的合成方法,写出以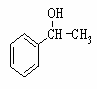 为原料制备
为原料制备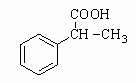 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
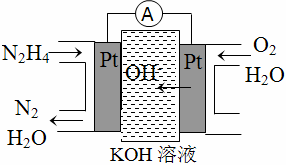
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
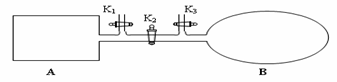
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生的实验报告所列出的下列数据中合理的是( )
|
| A. | 用10mL量筒量取7.13mL稀盐酸 |
|
| B. | 用托盘天平称量25.20g NaCl |
|
| C. | 用广泛pH试纸测得某溶液的pH为2.3 |
|
| D. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是( )
|
| A. | 10mL | B. | 5mL | C. | 大于5mL | D. | 小于5mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com