
【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
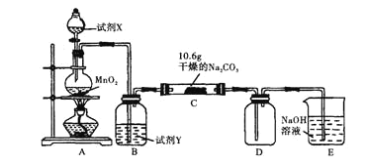
(1)写出装置A中发生反应的化学方程式:______。
(2)写出试剂Y的名称:______。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。充分反应后C中固体可能含有NaHCO3、NaCl、Na2CO3,为确定C中固体成分现设计如下实验:
步骤1:取C中少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。
步骤2:向A试管中滴加过量的稀HNO3溶液,产生大量气泡,_____(填能或不能)确定碳酸钠存在,再滴加AgNO3溶液,产生白色沉淀。
步骤3:向B试管中滴加BaCl2溶液,无明显现象。
则C中固体一定含_____,一定不含_____。
(4)已知C中有0.1molCl2参加反应,由(3)已知和结论,可推知C中反应的化学方程式为_____。
【答案】MnO2+4HCl![]() MnCl2+Cl2↑+2H2O 饱和的氯化钠溶液 不能 NaHCO3、NaCl Na2CO3 2Cl2+H2O+2Na2CO3=2 NaHCO3+ 2NaCl+Cl2O
MnCl2+Cl2↑+2H2O 饱和的氯化钠溶液 不能 NaHCO3、NaCl Na2CO3 2Cl2+H2O+2Na2CO3=2 NaHCO3+ 2NaCl+Cl2O
【解析】
本题探究的是潮湿的Cl2与Na2CO3反应得到的固体物质,开始为生成Cl2的装置,除去Cl2中的杂质后与Na2CO3反应,D是安全瓶,E中的氢氧化钠溶液为尾气的吸收装置。
(1)本题探究的是潮湿的Cl2与Na2CO3反应得到的固体物质,开始为生成Cl2的装置,实验室制取Cl2的反应为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)除去制备出来的Cl2中的HCl选择饱和的氯化钠溶液;
(3)充分反应后C中固体可能含有NaHCO3、NaCl、Na2CO3,将固体溶解后溶液中可能存在HCO3-、CO32-,Cl-,向A试管中滴加过量的稀HNO3溶液,产生大量气泡,可能存在HCO3-或CO32-,不能确定碳酸钠存在,再滴加AgNO3溶液,产生白色沉淀,说明存在Cl-;步骤3向B试管中滴加BaCl2溶液,无明显现象,说明不存在CO32-,综上反应后的固体中一定存在NaHCO3、NaCl,不存在Na2CO3;
(4)装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物,设化学式为ClOx,根据化合价升降守恒有x=![]() ,可得含氯氧化物为Cl2O,那么方程式为2Cl2+H2O+2Na2CO3=2 NaHCO3+ 2NaCl+Cl2O。
,可得含氯氧化物为Cl2O,那么方程式为2Cl2+H2O+2Na2CO3=2 NaHCO3+ 2NaCl+Cl2O。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为_________,中心原子的杂化形式为______;d的最高价氧化物分子构型为__________,中心原子的杂化形式为_______。
(2)g位于第________族,属于________区。写出其基态原子的电子排布式_____________________________。
(3)将f的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子,请写出生成此配离子的离子方程式:_______________________________________。
(4)CH3+、—CH3、CH3— 都是重要的有机反应中间体,有关它们的说法正确的是___________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3—与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3或一个CH3+和一个CH3—结合均可得到CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4LH2O水分子数为1NA
B.常温常压下,80gSO3含有的氧原子数为3NA
C.标准状况下,22.4L氦气中所含原子数为2NA
D.0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
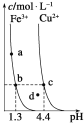
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kpa时,乙烷和乙炔组成的混合烃20mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了42mL,原混合烃中乙炔的体积分数为( )
A. 25%B. 40%C. 60%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
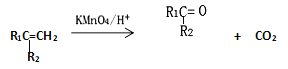
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。已知:
![]()
![]()
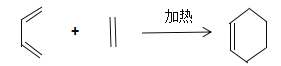

请回答下列问题:
(1)2-甲基-1,3-丁二烯可以与氢气、溴水等发生加成反应。
①完全与氢气加成所得有机产物的名称____________;
②与溴水发生1,2-加成所得有机产物的结构简式为____________ 和 _____________;
③与溴水发生1,4-加成反应的化学方程式为_______________________________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式________________________________________。
(3)Y(![]() )是天然橡胶的主要成分。能发生的反应有_________(填标号)。
)是天然橡胶的主要成分。能发生的反应有_________(填标号)。
A.加成反应 B.氧化反应 C.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________;X与乙醇发生酯化反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 足量乙酸与碳酸钠溶液反应: 2 CH3COOH +CO32-→ 2CH3COO-+CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O
C. 苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
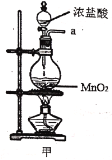
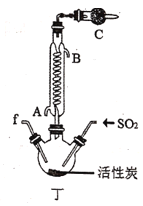
【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
(1)写出甲中制取Cl2的化学方程式___。
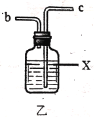
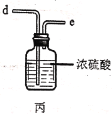
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com