
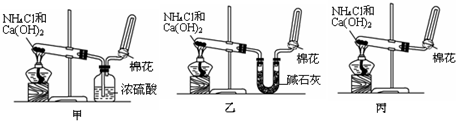
分析 ①实验室用加热氯化铵和氢氧化钙固体制备氨气,二者在加热条件下生成氯化钙、氨气和水;
②氨气为碱性气体,能够与硫酸反应生成硫酸铵;
③依据氨气为碱性气体能够使红色石蕊试纸变蓝的性质检验,或者依据氨气与氯化氢反应生成白色固体氯化铵的性质检验氨气的存在.
解答 解:①加热氯化铵和氢氧化钙固体生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
②甲同学用浓硫酸干燥氨气,氨气为碱性气体,能够与硫酸反应生成硫酸铵,方程式:2NH3+H2SO4=(NH4)2SO4,所以甲同学不能收集到气体;
故答案为:甲;2NH3+H2SO4=(NH4)2SO4;
③氨气的检验方法为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
故答案为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
点评 本题考查了氨气的制备和净化、收集,明确氨气制备原理及氨气的性质是解题关键,注意氨气检验方法,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9gH2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| D. | 标准状况下,11.2L CCl4所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:X<Y<W | B. | 简单氢化物的热稳定性:Y>Z | ||
| C. | 简单离子的半径:W>Y>Z | D. | 四种元素只能形成两种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | SO2和Na2SO3溶液都能使氯水褪色 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | 硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ AlO2- | B. | Na+ SO42- | C. | Cu2+ SO42- | D. | Na+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g氮气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L苯中含有NA个水分子化学反应中 | |
| C. | 0.5mol金属镁变成镁离子时失去电子的数目为NA | |
| D. | 标准状况下,22.4L氦气所含的原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com