
| A. | 反应中消耗的Zn的质量为97.5 g | B. | 气体A中SO2和H2的体积比为1:4 | ||
| C. | 反应中被还原的元素只有一种 | D. | 反应中共转移电子3 mol |
分析 锌与浓硫酸发生:Zn+2H2SO4═ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4═ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.0mol/L-0.05mol=1.75mol,然后根据反应的化学方程式计算.
解答 解:设气体A中SO2、H2的物质的量分别为x、y.
则根据两个反应方程式可知
$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=18.5×0.1-\frac{1}{2}×0.1×1}\end{array}\right.$
解之得x=0.3 mol;y=1.2 mol;
A、消耗Zn的质量为(x+y)×65 g/mol=97.5 g,故A正确;
B、气体A中SO2和H2的体积比为0.3:1.2=1:4,故B正确;
C、被还原的元素有S、H两种,故C错误;
D、转移电子数为1.5mol×2=3 mol,故D正确;故选C.
点评 本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,③根据反应的方程式利用守恒的方法列式计算.


科目:高中化学 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
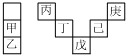 甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 气态氢化物的稳定性:庚<己<戊 | |
| B. | 庚与戊的原子序数相差24 | |
| C. | 庚与甲形成的单核离子半径大小为:庚<甲 | |
| D. | 丁的最高价氧化物可用于制造计算机的芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液:Al3+、NH4+ | |
| B. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 含等物质的量的Fe3+、Cu2+的溶液中,加入铁粉:Cu2+、Fe3+ | |
| D. | 含等物质的量的CH3COO-、ClO-溶液中,逐滴加入稀盐酸:CH3COO-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com