
 质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )| A. | c2=2c1 | B. | c2>2c1 | C. | c2<2c1 | D. | 无法确定 |
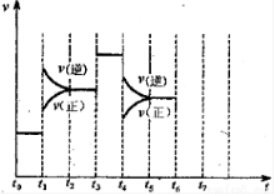
分析 设质量分数为a%的氨水的密度为dg/mL,质量分数为2a%的氨水的密度为Dg/mL,由图可知,氨气的浓度越大,密度越小,则d>D,再根据c=$\frac{1000ρω}{M}$进行判断.
解答 解:设质量分数为a%的氨水的密度为dg/mL,质量分数为2a%的氨水的密度为Dg/mL,
则c1=$\frac{1000d×a%}{17}$,c2=$\frac{1000D×2a%}{17}$,故$\frac{{c}_{1}}{{c}_{2}}$=$\frac{d}{2D}$,
由图可知,氨气的浓度越大,密度越小,则d>D,故c2<2c1,
故选:C.
点评 本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数关系.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用过滤的方法分离FeCl3溶液和Fe(OH)3胶体 | |
| B. | Fe(OH)3胶体静置会分层 | |
| C. | HCl、SO2、Fe2+均既有氧化性又有还原性 | |
| D. | CH3COONH4的电离方程式为:CH3COONH4 CH3COO-+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同,但不一定是22.4 L | B. | 分子数相同,但原子数不同 | ||
| C. | 摩尔质量不同,氧原子个数相同 | D. | 质子数不同,电子数也不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com