
分析 (1)浓硫酸具有强氧化性,它可把不活泼的金属铜氧化.氧化还原反应中化合价升高,失电子做还原剂被氧化,发生氧化反应,其产物为氧化产物;化合价降低,得到电子做氧化剂,被还原,发生还原反应;
(2)反应中Cu的化合价从0价升高到-2价,结合方程式计算;
(3)氧化还原反应中还原剂的还原性大于还原产物.
解答 解:(1)浓硫酸具有强氧化性,它可把不活泼的金属铜氧化.反应中浓硫酸中S的化合价降低,浓硫酸作氧化剂,Cu失电子做还原剂被氧化,其产物CuSO4为氧化产物;
故答案为:氧化;氧化;CuSO4;
(2)反应中Cu的化合价从0价升高到-2价,消耗了32g Cu,即$\frac{32g}{64g/mol}$=0.5mol,则转移电子为1mol,由Cu+2H2SO4(浓)?CuSO4+SO2↑+2H2O可知,还原了0.5mol硫酸,生成0.5mol二氧化硫,即11.2L;
故答案为:1;0.5;11.2;
(3)氧化还原反应中还原剂的还原性大于还原产物,反应中Cu作还原剂,SO2作还原产物,则还原性:Cu>SO2,故答案为:>.
点评 本题考查了氧化还原反应的概念判断,主要是氧化还原反应的特征应用,化合价的变化判断是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 铝与盐酸反应:2Al+6H+=2Al3++3H2↑ | |
| C. | 氢氧化铝与盐酸反应:OH-+H+=H2O | |
| D. | 氯化铝与氨水反应:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .E中含氧官能团的名称为醛基和羟基.
.E中含氧官能团的名称为醛基和羟基. .写出有关反应的类型:②氧化反应⑥消去反应.
.写出有关反应的类型:②氧化反应⑥消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
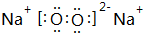 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com