
| A. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸可以干燥H2、NH3、CO2等气体 | |
| D. | SO2的漂白原理与次氯酸相同 |
分析 A.浓硫酸具有强的氧化性,能够与铝反应生成致密氧化膜;
B.硫在氧气中燃烧生成二氧化硫;
C.浓硫酸具有酸性,不能干燥碱性气体;
D.根据SO2、次氯酸漂白性的原理分析.
解答 解:A.浓硫酸具有强的氧化性,能够与铝反应生成致密氧化膜而使铝钝化,阻止反应进行,所以可用铝槽车储运浓硫酸,故A正确;
B.硫在氧气中燃烧生成二氧化硫,故B错误;
C.氨气为碱性气体,能够与浓硫酸反应,被浓硫酸吸收,不能用浓硫酸干燥,故C错误;
D.二氧化硫的漂白性是利用有色物质和二氧化硫反应生成无色物质,次氯酸的漂白性是利用次氯酸的强氧化性,所以二者漂白原理不同,故D错误;
故选:A.
点评 本题考查了元素及其化合物的性质,明确物质的性质是解本题关键,知道二氧化硫、臭氧、活性炭、次氯酸漂白原理,难度不大,注意钝化属于化学变化.


科目:高中化学 来源: 题型:选择题
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
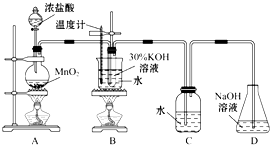 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com