
【题目】下列叙述正确的是
A. 因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B. 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C. 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D. 将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请你利用下列反应“Cu + 2Ag+ = 2Ag + Cu2+”设制一个化学电池:
①画出合理的原电池装置图_____________________________ (标明正负极、电极材料和电解质溶液)
②正极质量_____(填“增加”、“减少”或“不变”,下同),负极质量______
(2)甲烷燃料电池的工作原理如图所示.

①该电池工作时,b口通入的物质为______,c口通入的物质为______;
②该电池负极的电极反应式为:_____________________________;
③工作一段时间后,当3.2g甲烷完全反应生成CO2时,有_______个电子转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下面是7×18的格子,按要求作答。

(1)用封闭的实线绘出元素周期表的轮廓。_______________
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大、温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素,已知这种元素的一种核素没有中子。你由此可知最先产生的元素是________ (填写元素名称),该元素的另一种核素,其中子数比质子数多1,此种核素的原子符号是________。
(3)C、D、E、F的简单离子半径由小到大的顺序是____________(填写离子符号)。
(4)请用电子式表示出E和H组成的化合物的形成过程:_________________。
(5)用实线绘出金属与非金属的分界线;用实线绘出过渡元素的分界线。_____________
(6)请写出B形成的单质与氢气反应的化学方程式:______________。
(7)下列各种叙述中,正确的是__________。
a.化学键可分为离子键、共价键、极性键和非极性键四种类型
b.由非金属元素组成的化合物不一定是共价化合物
c.非极性键只存在于双原子单质分子里
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,可以说明氯元素的非金属性比硫元素强
e.卤素氟、氯、溴、碘的氢化物的沸点由低到高的顺序为:HF<HCl<HBr<HI
f.构成单质分子的粒子不一定含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法中错误的是
A. H2(HCl):通过水洗涤 B. NO(NH3):通过水洗涤
C. NO2(NO):通入过量氧气 D. NH4Cl溶液(I2):用CC14萃取并分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
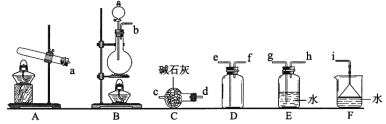
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
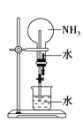
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 向纯碱溶液中滴加醋酸,将生成的气体通入澄清的苯酚钠溶液中,观察是否出现沉淀,由此证明醋酸、碳酸、苯酚酸性强弱
C. 反应A(g)![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子不能大量共存于同一溶液中的是
A. NH4+、NO3-、Fe2+、H+ B. NO3-、Na+、Ba2+、Ag+
C. C1-、Cu2+、SO42-、NO3- D. SO42-、NO3-、K+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U 形管)构成一个原电池如图所示。以下有关该原电池的叙述正确的是( )
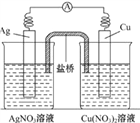
A. 在外电路中,电流由铜电极流向银电极
B. 该装置是将电能转化为化学能
C. 实验过程中取出盐桥,原电池仍继续工作
D. 正极反应为:Ag++e-===Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com