
| 元素编号 | 元素特征信息 |
| A | 阳离子核外无电子 |
| B | 最高正价和最低负价的绝对值之差为2 |
| C | 最外层电子数是内层电子数的3倍 |
| D | 1molD单质能与冷水反应,在标准状况下生成11.2LH2 |
| E | 原子最外层电子数等于其周期序数 |
| F | 负二价阴离子的电子层结构与Ar原子相同 |
 ;
;分析 短周期元素A、B、C、D、E、F的原子序数依次增大.A的阳离子核外无电子,则A为H元素;C元素原子最外层电子数是内层电子数的3倍,最外层电子数不超过8,故有2个电子层,最外层电子数为6,则C为O元素;B原子最高正价和最低负价的绝对值之差为2,处于VA族,原子序数小于氧,故B为N元素;1molD单质能与冷水反应,在标准状况下生成11.2LH2,生成氢气为0.5mol,D表现+1价,原子序数大于氧,故D为Na;E、F均处于第三周期,E元素原子最外层电子数等于其周期序数,则E为Al,F元素原子负二价阴离子的电子层结构与Ar原子相同,则F为S元素.
解答 解:短周期元素A、B、C、D、E、F的原子序数依次增大.A的阳离子核外无电子,则A为H元素;C元素原子最外层电子数是内层电子数的3倍,最外层电子数不超过8,故有2个电子层,最外层电子数为6,则C为O元素;B原子最高正价和最低负价的绝对值之差为2,处于VA族,原子序数小于氧,故B为N元素;1molD单质能与冷水反应,在标准状况下生成11.2LH2,生成氢气为0.5mol,D表现+1价,原子序数大于氧,故D为Na;E、F均处于第三周期,E元素原子最外层电子数等于其周期序数,则E为Al,F元素原子负二价阴离子的电子层结构与Ar原子相同,则F为S元素.
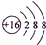
(1)F的简单离子为S2-,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)E为Al元素,在周期表中的位置为:第三周期ⅢA族,故答案为:第三周期ⅢA族;
(3)C和D简单离子分别为O2-、Na+,二者电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故答案为:O2->Na+;
(4)a.物质的颜色属于物理性质,不能比较非金属性强弱,故a错误;
b.非金属性越强,氢化物越稳定,故b正确;
c.同周期自左而右非金属性减弱、同主族自上而下非金属性增强,故c正确;
d.两元素单质在自然界中都有化合态、游离态,不能比较非金属性强弱,故d错误,
故选:bc;
(5)A、C、D三种元素组成的化合物为硝酸、硝酸铵等,一定含有的化学键为共价键,
故答案为:共价键.
点评 本题考查结构性质位置关系应用,题目比较基础,注意掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和6 mol H2反应 | |
| D. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A2)=0.4 mol•L-1•s-1 | B. | υ(B2)=0.8 mol•L-1•s-1 | ||
| C. | υ(C)=0.6 mol•L-1•s-1 | D. | υ(D)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
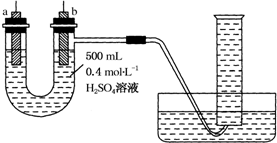 实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 被提纯物质 | 除杂试剂 | 分离方法 |
| ① | 苯甲酸(不溶于水的杂质) | 水 | 过滤、重结晶 |
| ② | 乙酸乙酯(醋酸) | 氢氧化钠溶液 | 分液 |
| ③ | 乙醇(4%的水) | 生石灰 | 蒸馏 |
| ④ | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com