
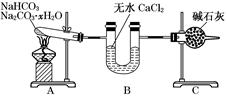
 Na2CO3+CO2↑+H2O、Na2CO3·xH2O= Na2CO3+ xH2O;B装置为干燥装置,其作用为吸收水分;C装置为装有碱石灰的干燥管,也其干燥作用,但是同时也起到吸收CO2的作用。(4)B管增重1.89 g为H2O的质量,C管增重0.22 g为CO2的质量;由化学方程式可得以下关系式:
Na2CO3+CO2↑+H2O、Na2CO3·xH2O= Na2CO3+ xH2O;B装置为干燥装置,其作用为吸收水分;C装置为装有碱石灰的干燥管,也其干燥作用,但是同时也起到吸收CO2的作用。(4)B管增重1.89 g为H2O的质量,C管增重0.22 g为CO2的质量;由化学方程式可得以下关系式: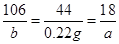 ,
, ,解得
,解得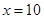 。(5)该装置中由于C装置碱石灰也可吸收空气中的CO2和水,会导致最终结果偏小。因此可在C装置后再连接一个装有碱石灰的干燥管或U型管。3和Na2CO3的性质
。(5)该装置中由于C装置碱石灰也可吸收空气中的CO2和水,会导致最终结果偏小。因此可在C装置后再连接一个装有碱石灰的干燥管或U型管。3和Na2CO3的性质

科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3的俗称是苏打 |
| B.Na2CO3溶液显碱性,说明Na2CO3属于碱 |
| C.相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 |
| D.向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,后者反应速率快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在水中溶解性:Na2CO3<NaHCO3 |
| B.热稳定性:Na2CO3<NaHCO3 |
| C.与酸反应的速度:Na2CO3<NaHCO3 |
| D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠浮在水面上 | B.钠熔化成小球并在水面上游动 |
| C.有无色无味的气体生成 | D.水溶液变为红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3.38 g | B.4.58 g | C.4.16 g | D.4.41 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠投入水中会发生剧烈反应,生成NaOH和H2 |
| B.金属钠长期暴露在空气中,它的最终产物是NaHCO3 |
| C.钠在空气中燃烧,燃烧产物是Na2O2 |
| D.金属钠在自然界不能以游离态存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
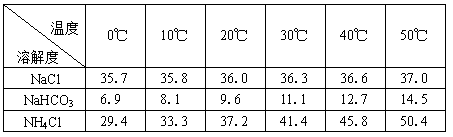
 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示: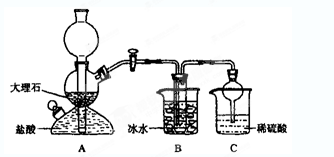
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com