
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①![]()
②![]()
③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
【答案】B
【解析】
①质量分数=质量溶质/溶液的质量×100%;
②根据![]() 计算;
计算;
③根据氨水的密度小于水分析;
④根据反应后溶液中的溶质,结合盐类水解分析。
①氨气溶于水,以NH3作为溶质,氨气的物质的量是![]() ,质量是
,质量是![]() ,溶液质量是ρV g,则
,溶液质量是ρV g,则![]() ,①错误;
,①错误;
②根据以上分析可知氨气的浓度C=![]() ,②正确;
,②正确;
③水的密度比氨水的密度大,所以上述溶液中再加入VmL水后,混合后溶液的质量大于2倍的原氨水的质量,溶质氨气的质量不变,所以所得溶液的质量分数小于0.5ω,③错误;
④上述溶液中再加入1.5V mL同浓度稀盐酸,与氨水反应生成氯化铵,盐酸过量,溶液为氯化铵与氯化氢的混合溶液,浓度之比为2:1,溶液呈酸性,c(H+)>c(OH-),铵根离子水解,水解程度微弱,所以c(Cl-)>c(NH4+),因此充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),④正确;
答案选B。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 23g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数N(O2)的范围为:0.25 NA< N(O2)< 0.5 NA
B. 2 mol NO和1 mol O2在密闭容器中充分反应,反应后容器中的分子数小于2NA
C. 2.5gMg-Zn合金与足量盐酸反应,放出的气体在标况下的体积可能为2.24L
D. 50 mL 18.4 mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关过氧化氢的叙述正确的是( )
A. 过氧化氢是离子化合物
B. 过氧化氢分子只含有极性键
C. 过氧化氢分子只含有非极性键
D. 过氧化氢分子既含有非极性键又含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是基础化工的重要产品,工业上制备硫酸的主要反应为:
造气: 4 FeS2 +11O2 ![]() 2 Fe2O3+ 8 SO2
2 Fe2O3+ 8 SO2
催化氧化: 2 SO2 + O2 ![]() 2 SO3
2 SO3
吸收: SO3 + H2O → H2SO4
完成下列填空:
(1)一定条件下,1 mol SO2和0.75 mol O2在容积为1 L的恒容密闭容器中发生反应,5 min时达到化学平衡。
①反应达到平衡后若改变条件使平衡常数K值变大,则在平衡移动过程中υ(正) _______(填序号)
a.一直增大 b.一直减小 c.先增大后减小 d.先减小后增大
②达到平衡时若SO3的浓度为0.98 mol·L-1,则5min内氧气的反应速率为_________ mol·L-1·min-1。反应体系中氧气过量的目的是_____________________。
(2)催化氧化反应中,SO2的平衡转化率与温度、压强的关系如图所示。则工业生产中最适宜的压强为___________,最适宜的温度范围为___________。

(3)若制取硫酸的上述三个反应过程中硫元素的转化率都是98%, 则1 mol硫铁矿可以制得SO2____________L(标准状况下),最终得到纯硫酸______________mol(均保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对熟石灰的悬浊液加热,悬浊液中固体质量增加
B. 实验室中常用排饱和食盐水的方式收集氯气
C. 打开汽水瓶,有气泡从溶液中冒出
D. 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)
N2O4(g)(无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。

分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中____。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生_____。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。
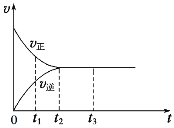
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
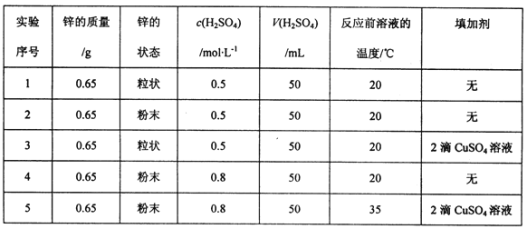
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
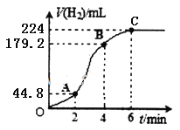
在OA、AB、BC三段中反应速率最快的是__,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com