
 .
.分析 (1)电子层数越多半径越大,电子层数相同时核电荷数越多半径越小;
(2)Al原子核外有13个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p1;有5种能级;Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝;
(3)工业上用氯气和石灰乳反应生成氯化钙和次氯酸钙,来制取漂粉精;而吸收多余氯气的试剂是浓的氢氧化钠溶液;
(4)硫是弱氧化剂,只能将铁氧化成亚铁,所以硫磺粉末与铁粉混合加热,生成硫化亚铁,由此标出电子转移的方向和数目;
(5)同周期从左到右非金属性增强;从置换反应判断元素非金属性强弱分析,要在Na2S溶液中发生氯气置换出硫的反应;从原子结构的特点思考,Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.
解答 解:(1)电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,铁是四个电子层,铝、硫、氯只有三个电子层,所以半径大小为:Fe>Al>S>Cl,故答案为:Al;S;Cl;
(2)Al原子核外有13个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p1;有5种能级,Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:1s22s22p63s23p1;5;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)工业上用氯气和石灰乳反应生成氯化钙和次氯酸钙,来制取漂粉精;而吸收多余氯气的试剂是浓的氢氧化钠溶液,故答案为:石灰乳;浓的氢氧化钠溶液;
(4)硫是弱氧化剂,只能将铁氧化成亚铁,所以硫磺粉末与铁粉混合加热,生成硫化亚铁,反应的化学方程式为:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,所以电子转移的数目为: ,故答案为:
,故答案为: ;
;
(5)硫的非金属性弱于氯,可从Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓,应用氧化剂的氧化性强于氧化产物的氧化性,从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;故答案为:弱;氯气通入硫化钠溶液中有黄色沉淀生成;Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
点评 本题应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程.


科目:高中化学 来源: 题型:选择题
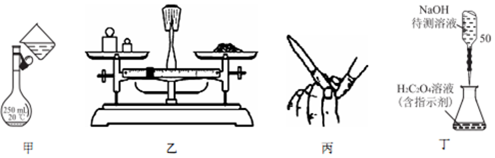
| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
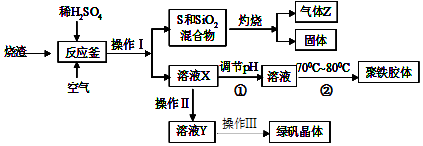
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
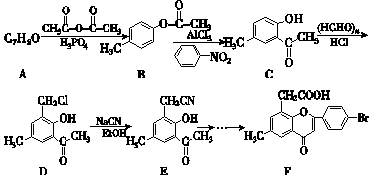
 +2NaOH→
+2NaOH→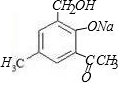 +H2O+NaCl.
+H2O+NaCl.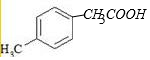 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的或结论 | |
| A | 蘸有浓硝酸的玻璃棒靠近浓氨水时冒白烟 | NH3具有还原性 |
| B | 将一块Na放入乙醇溶液中,有气泡产生 | Na能置换乙醇中的氢 |
| C | 可将58.5gNaCl加入盛有500mL水的烧杯中,搅拌、溶解 | 粗略配置浓度为2mol•L-1的NaCl溶液 |
| D | 向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3 | 验证氯仿中含有的氯元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4-、Al3+ | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32-、CO32- | |
| C. | 含有大量AlO2-的溶液中:K+、HCO3-、Br-、Na+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,最终溶液中无沉淀,阴离子种数减少3种,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (Υ1+Υ2-Υ3)L | B. | (Υ1+Υ2+Υ3)L | C. | (Υ1+Υ2-2Υ3)L | D. | [Υ3-(Υ1+Υ2)]L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HCl | B. | 熔、沸点:HI>HCl | ||
| C. | 同浓度的HI和HCl的酸性:HI>HCl | D. | 还原性:HI>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com