
(7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
(1)④>②>①>③(2分);
(2)Al2O3(1分);Al3++3H2O Al(OH)3+3H+,2Al(OH)3
Al(OH)3+3H+,2Al(OH)3 Al2O3+H2O(2分);
Al2O3+H2O(2分);
(3)11(2分)
解析试题分析:(1)一水合氨为弱电解质,溶液中c(NH4+)最小;相同浓度的铵盐溶液中,NH4+系数越大,c(NH4+)越大,相同系数、相同浓度的铵盐溶液中,NH4+水解程度越大,则溶液中c(NH4+)越小,H+抑制铵根离子水解、CH3COO-促进NH4+水解,所以相同浓度的这几种溶液中c(NH4+)由大到小的顺序为④>②>①>③,故答案为:④>②>①>③。
(2)氯化铝能水解生成氢氧化铝,氯化氢具有挥发性,加热促进氯化氢挥发,从而促进氯化铝水解,则蒸干溶液时得到Al(OH)3固体,灼烧Al(OH)3固体时分解得到Al2O3,反应方程式为,故答案为:Al2O3;Al3++3H2O?Al(OH)3+3 H+、2Al(OH)3 Al2O3+H2O。
Al2O3+H2O。
(3)某温度时蒸馏水的pH=6,则水的离子积常数K=10-12,2.3gNa的物质的量为0.1mol,根据原子守恒得n(NaOH)=n(Na)=0.1mol,则C(NaOH)=0.1mol÷1L=0.1mol/L,溶液中c(H+)=10-11 mol/L,则pH为11。
考点:本题考查离子浓度大小比较、盐类水解、pH的计算。


科目:高中化学 来源: 题型:单选题
常温下,将V1mL c1mol/L的醋酸滴加到V2mL c2mol/L的氢氧化钠溶液中,下列结论正确的是
| A.若将c1mol/L的醋酸冲稀10倍,则其pH增大1 |
| B.若将c2 mol/L的氢氧化钠溶液冲稀10倍,则其pH减小1 |
| C.若c1? V1=c2?V2,则混合液中c(CH3COO-)=c(Na+) |
| D.若混合液的pH=7,则混合液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是( )
| A.粗铜精炼时,阳极产生0.5molCu2+则阴极有NA个Cu原子析出 |
| B.因为酸性H2SO3>H2CO3,所以S得电子能力大于C |
| C.可通过比较Mg(OH)2和MgCO3的Ksp的大小 比较它们的溶解性 |
| D.含0.1molNaClO的溶液蒸干可得5.85gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-) |
| D.硫化钠溶液中,C (Na+) =" 2" C (S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: |
B.已知NaHSO3溶液 ,该溶液中: ,该溶液中: |
C.当吸收液呈中性时: |
D.当吸收液呈酸性时: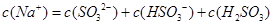 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c(HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com