
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化碳的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
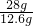 ×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.
×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.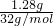 =0.04mol,由S2O32-+2H+=S↓+SO2↑+H2O可知,样品中硫代硫酸钠为0.04mol,该反应生成的二氧化硫为0.04mol,反应得到的二氧化硫总的物质的量为
=0.04mol,由S2O32-+2H+=S↓+SO2↑+H2O可知,样品中硫代硫酸钠为0.04mol,该反应生成的二氧化硫为0.04mol,反应得到的二氧化硫总的物质的量为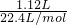 =0.05mol>0.04mol,故含有Na2SO3,反应SO32-+2H+=SO2↑+H2O生成二氧化硫为0.05mol-0.04mol=0.01mol,由方程式可知,样品中Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g<12.6g,
=0.05mol>0.04mol,故含有Na2SO3,反应SO32-+2H+=SO2↑+H2O生成二氧化硫为0.05mol-0.04mol=0.01mol,由方程式可知,样品中Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g<12.6g, =0.01mol,
=0.01mol,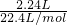 =0.1mol,故该硫酸的物质的量浓度为
=0.1mol,故该硫酸的物质的量浓度为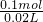 =5mol/L,
=5mol/L,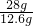 ×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.
×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.

科目:高中化学 来源: 题型:
(11分)Pb3O4为红色粉末状固体,该物质为混合价态氧化物,化学式可写成2PbO?PbO2,如果用传统的方法测定其组成,存在很多不足。经过反复实验发现了一种连续测定法,仅用0.5h就足以完成从样品称量、溶解、滴定直至计算实验结果。
实验方法如下:准确称取0.0400g~0.0500g干燥好的Pb3O4固体,置于250mL锥形瓶中。加入HAc-NaAc(11)10mL,再加入0.2mol/L KI溶液1~2mL充分溶解,使溶液呈透明橙红色。加0.5mL 2%淀粉溶液,用0.01mol/L Na2S2O3标准溶液滴定使溶液由蓝色刚好褪去为止,记下所用去的Na2S2O3标准溶液的体积为V(S2O32-)。再加入二甲酚橙3~4滴,用0.01mol/L EDTA标准液滴定溶液由紫红色变为亮黄色时,即为终点。记下所消耗的EDTA溶液的体积为V(EDTA)。
1.请用化学方程式表示上面的化学原理:
2.选择适宜的酸溶解Pb3O4是本实验的关键,请分别说明不能使用实验室三种常见无机酸的原因:
3.为准确滴定Pb2+离子,选择溶液最佳酸度也是一个重要因素,请分析原因
4.列出Pb3O4组成的计算式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com