
【题目】有关下列离子方程式的说法正确的是( )
A.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B.向NaAlO2溶液中通入少量的CO2的反应为:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
C.FeBr2与足量的Cl2反应为:2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4—+6H++5H2O2=2Mn2++5O2↑+8H2O
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律知识解释的是
A. 非金属性:O > S B. 稳定性:HCl >H Br
C. 酸性:HCl > H2CO3 D. 碱性: LiOH <NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B.图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C.图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D.图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
H2O(g) == H2(g) + O2(g) △H=" +241.8" kJ·mol-1
H2(g)+ O2(g) == H2O(1) △H= -285.8 kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是( )
A. 吸热88kJ B. 吸热2.44 kJ C. 放热44kJ D. 吸热44 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与对应化学(或离子)方程式都正确的是( )
A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;
Na + H2O ![]() Na+ + OH- + H2↑
Na+ + OH- + H2↑
B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 ![]() 2HCl
2HCl
C.铜与稀硝酸反应:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
D.少量SO2通入Ca(ClO)2溶液中:SO2+ H2O + Ca2+ + 2ClO- = CaSO3↓+ 2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为3L的密闭容器里进行如下反应N2(g)+ 3H2(g)![]() 2NH3(g) ,反应开始时n(N2)=1.5mol, n(H2)=4.4mol, 2min末n(H2) =3.5mol。则:
2NH3(g) ,反应开始时n(N2)=1.5mol, n(H2)=4.4mol, 2min末n(H2) =3.5mol。则:
(1)用NH3的浓度变化来表示该反应的速率为 ;
(2)2min末时N2的浓度为 ;
(3)氮气的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴和碘的化合物在生产和生活中有广泛的用途.
(1)市场销售的某种食用精制盐中含碘酸钾。
①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
![]()
②上述反应生成的I2可用四氯化碳检验,现象为________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是________________________。
(2)海水提溴过程中溴元素的变化如下:
![]()
①过程I,海水显碱性,调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
②过程II,用热空气将溴赶出,再用浓Na2CO3溶液吸收。完成并配平下列方程式。
![]()
③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
④NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入 2.6molNaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
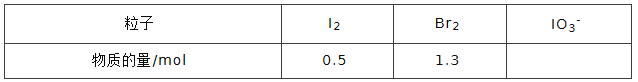
则原溶液中NaI的物质的量为_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com