
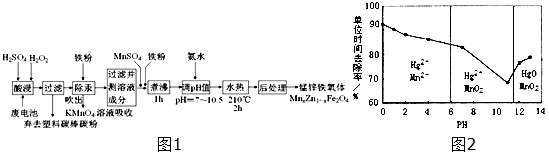
分析 废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体,
(1)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成;
(2)利用铁粉把Hg还原出来;
(3)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
③酸性条件下有Mn2+生成,可能是Mn2+具有催化作用;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;
(5)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
解答 解:废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体,
(1)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成,反应方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
(3)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由图象可知,汞的吸收率随着PH的增大先降低后增加,
故答案为:随pH的升高汞的吸收率先降低后增加;
③不考虑酸性条件下氧化性增强因素,酸性条件下有Mn2+生成,可能是Mn2+具有催化作用,强酸性环境下汞的单位时间去除率高,
故答案为:Mn2+具有催化作用,强酸性环境下汞的单位时间去除率高;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,
故答案为:MnO•4ZnO•5Fe2O3;
(5)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成,
故答案为:调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
点评 本题考查物质制备,为高频考点,侧重考查学生分析、实验操作及知识运用能力,涉及氧化还原反应、物质分离和提纯等知识点,明确流程图中各个部分发生的反应及基本操作方法是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A. | CH4(g)+2O2(g)═CO2 (g)+2 H2O ( l)△H=-890.3 kJ/mol | |
| B. | 质量相等的CH4比C2H2燃烧放出热量少 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纤维素可在人体内水解成葡萄糖 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 用灼烧的方法可以鉴别毛织物和棉织物 | |
| D. | 油脂是产生能量最高的营养物质,在饮食中不必控制油脂的摄入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
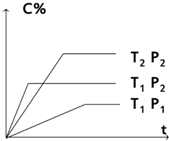 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com