
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | H2CO3 | HClO |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3×10-8 |
| A. | lmolCl2通入足量的水中充分反应,转移的电子数约为6.02×1023 | |
| B. | 将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O | |
| C. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值不变 | |
| D. | 向浓度均为1×103 mol/L-1的KC1和K2CrO4混合溶液中滴加1×10-3 mol/L-1的AgNO3溶液Cl-先沉淀 |
分析 A.氯气和水的反应是可逆反应;
B.碳酸的酸性强于次氯酸,化学反应遵循强酸制备弱酸的道理;
C.常温下,用蒸馏水不断稀释醋酸,醋酸根离子浓度减小,K不变,结合K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$来回答;
D.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀.
解答 解:A.氯气和水的反应是可逆反应,lmolCl2通入足量的水中充分反应,转移的电子数小于6.02×1023,故A错误;
B.碳酸的酸性强于次氯酸,将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O,故B正确;
C.常温下,用蒸馏水不断稀释醋酸,醋酸根离子浓度减小,K不变,K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值减小,故C错误;
D.AgCl饱和所需Ag+浓度c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\sqrt{\frac{1.8×1{0}^{-10}}{1{0}^{-3}}}$=1.8×10-7,Ag2CrO4饱和所需Ag+浓度c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{{O}_{4}}^{2-})}}$=4.472×10-5,1.8×10-7<4.472×10-5,所以Cl-先沉淀,故D正确;
故选BD.
点评 本题考查较为综合,题目难度中等,涉及化学平衡常数的应用、电子转移的计算、弱酸的稀释等方面的知识,明确弱电解质的电离平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
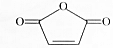
| A. | 分子式为C4H2O3 | B. | 能发生水解反应 | ||
| C. | 一氯代物有2种 | D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 候氏制碱、制取肥皂的工艺过程中均应用了物质溶解度的差异 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 | |
| D. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
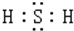 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微电池的负极是Mg | B. | 微电池的负极是Al | ||
| C. | 铝的电极反应式为2H++2e-═H2↑ | D. | 镁的电极反应式为Mg-2e-═Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
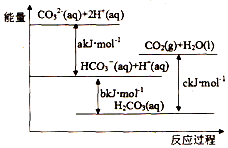
| A. | H2CO3(aq)=CO2(g)+H2O(l)为放热反应 | |
| B. | CO32-(aq)+H+(aq)=HCO3-(aq)△H=akJ/mol | |
| C. | HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)△H=(c-b)kJ/mol | |
| D. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(a+b-c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入 AgNO3溶液,再加入稀 HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入 NaOH 溶液共热,然后加入稀 HNO3使溶液呈酸性,再滴入 AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入 NaOH 溶液共热,冷却后加入 AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据元素在周期表中的位置,推测元素的原子结构 | |
| B. | 指导新元素的发现和合成,预测新元素的性质 | |
| C. | 在金属与非金属的分界线附近寻找半导体材料 | |
| D. | 在零族元素中寻找耐腐蚀的金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com