
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl﹣)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)═2c(HCO3﹣)+2c(H2CO3)+2c(CO ![]() )
)
D.pH=1的NaHSO4溶液:c(H+)═2c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
【答案】B
【解析】解:A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,反应后溶质为等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解,溶液呈酸性,则:c(H+)>c(OH﹣)、c(Na+)=c(SO ![]() )>c(NH4+),正确的离子浓度大小为:c(Na+)=c(SO
)>c(NH4+),正确的离子浓度大小为:c(Na+)=c(SO ![]() )>c(NH4+)>c(H+)>c(OH﹣),故A错误; B.混合溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得:c(H+)+c(Na+)=c(Cl﹣)+c(OH﹣)+c(CH3COO﹣),所以c(Na+)>c(Cl﹣),根据物料守恒得:c(Na+)=c(CH3COOH)+c(CH3COO﹣),故c(Cl﹣)=c(CH3COOH),所以溶液中存在离子浓度大小顺序为:c(Na+)>c(Cl﹣)=c(CH3COOH)>c(H+)=c(OH﹣),故B正确;
)>c(NH4+)>c(H+)>c(OH﹣),故A错误; B.混合溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得:c(H+)+c(Na+)=c(Cl﹣)+c(OH﹣)+c(CH3COO﹣),所以c(Na+)>c(Cl﹣),根据物料守恒得:c(Na+)=c(CH3COOH)+c(CH3COO﹣),故c(Cl﹣)=c(CH3COOH),所以溶液中存在离子浓度大小顺序为:c(Na+)>c(Cl﹣)=c(CH3COOH)>c(H+)=c(OH﹣),故B正确;
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中,根据物料守恒可得:2c(HClO)+2c(ClO﹣)═c(HCO ![]() )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO ![]() ),故C错误;
),故C错误;
D.NaHSO4溶液中,根据电荷守恒可得:c(Na+)+c(H+)═2c(SO42﹣)+c(OH﹣),故D错误;
故选B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )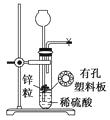
①食盐水②KNO3溶液③适量稀硫酸铜溶液
④Na2CO3溶液⑤CCl4⑥浓氨水
A.①③⑤
B.②⑥
C.③⑤
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下: 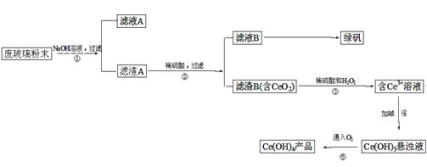
(1)写出第①步反应的离子方程式。
(2)洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。
(3)写出第③步反应的化学方程式。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式:
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
B | Zn片插入NaOH溶液中 | 有无色气体产生 | Al和Zn都能与强碱溶液反应 |
C | 将表面积相等的Mg、Al、Zn片投入浓度相等温度相同的盐酸中 | 产生气泡的速率相等 | Mg、Al、Zn的金属性强弱相同 |
D | 将点燃的镁条伸入到盛满CO2的集气瓶中 | 火焰熄灭 | CO2有灭火作用 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在家自制“84消毒液”,他根据84消毒液标签上的配方,用NaC1O固体配制480mL质量分数为25%的、密度为1.19g/cm3的NaC1O消毒液.下列说法正确的是( )
A.容量瓶用蒸馏水洗净后需晾干才能使用
B.需称取NaClO固体144g
C.所配得NaClO消毒液久置后会失效
D.8 4消毒液的消毒原理是利用了NaClO的强碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu) 中各成分的质量分数。取两份质量均为mg的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1mL和V2 mL(已折算到标准状况下)。
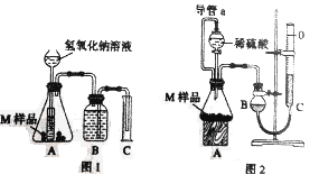
(1)写出实验1中可能发生反应的离子方程式:________________________;
(2)M样品中铜的质量的数学表达式为(用V1和V2表示):_________________________。
(3)实验1进行实验前,B瓶中水没有装满,使测得气体体积________________________。(填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________________。
(4)该实验需要0.50 mol·L-1的NaOH溶液470mL,配制时应用托盘天平称量______________gNaOH 。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3) 配制的,欲用该浓硫酸配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需______________、______________、______________。
②所取浓硫酸的体积为_________mL。
下列操作引起所配溶液浓度偏高的是________________
A.取浓硫酸时俯视 B.在烧杯中稀释浓硫酸后,立即转移
C.定容时俯视 D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2 , 溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B.
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
c.检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
(1)比色法的基本依据是;
(2)若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为mg/L.
(3)用NaNO2直接配制溶液B的缺点是 .
(4)如果水样显色后比6号还深,应采取的措施是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com