
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量?
请回答下列问题:
(1)该实验的目的是_________________?
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g?若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是_____________________?
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
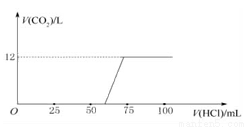
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL?
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?_______________ ____________?
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:推断题
有机化合物G常用作香料。合成G的一种路线如下:

已知以下信息:
① A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢
② CH3CH2CH=CH2 CH3CHBrCH=CH2
CH3CHBrCH=CH2
③ CH3CHO+CH3CHO
 、
、 CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
回答下列问题:
(1)A的结构简式为______________,D中官能团的名称为____________________。
(2)B→C的反应类型为_______________。
(3)D→E反应的化学方程式为_________________________________。
(4)检验M是否已完全转化为N的实验操作是___________________________。
(5)满足下列条件的L的两种同分异构体有 种(不考虑立体异构)。① 能发生银镜反应 ② 能发生水解反应。其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的结构简式为 。
(6)参照上述合成路线,设计一条以1-丁醇和NBS为原料制备顺丁橡胶( )的合成路线:___________________________。
)的合成路线:___________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(Na+)>c(B-)> c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
工业上可由乙苯生产苯乙烯:过程如下图,下列说法正确的是

A.乙苯的同分异构体共有三种
B.可用Br2/CCl4鉴别乙苯和苯乙烯
C.乙苯和苯乙烯分子中均含有碳碳双健
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )

A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加在足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol/L HCl B.4 mol/L HNO3 C.8 mol/L NaOH D.18 mol/L H2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:

I、制备研究:工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3·3H2O2), “醇析法”的生产工艺流程如下:

请回答问题:
(1)Na2CO3俗名:_______________;其水溶液能使酚酞变_______________;
(2)H2O2受热容易分解,写出该分解反应的方程式:_________________;
(3)生产过程中,反应及干燥均需在低温度下进行,原因是________________;
(4)生产过程中,加入较多无水乙醇后,过碳酸钠晶体大量析出,此无水乙醇的作用可能是_________________;
(5)操作A的名称是______________,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和_____________;
(6)母液可以循环使用,但须进行“一系列操作”分离,这些操作包括:加入少量___________,不再有气泡产生后,过滤,将所得滤液再进行______________(填操作名称),即可得Na2CO3溶液和95%的乙醇。为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后,选__________(填序号)装置进行实验。

II、纯度测定:兴趣小组同学设计了如图1所示实验装置(部分仪器略去),测定过碳酸钠样品中2Na2CO3·3H2O2的质量分数。步骤如下:

① 连接仪器并检查好气密性
② 将过碳酸钠样品(2.20g)和少许MnO2均匀混合后置于装置A中,在量筒中加满水;
③ 连接仪器,打开滴液漏斗活塞,缓缓滴入水;
④ 待装置A中_____________时,停止滴加水,并关闭活塞;
⑤ 冷却至室温后,平视读数;
⑥ 根据数据进行计算。
请回答下列问题:
(7)完善实验步骤的相关内容:④ __________;
(8)第⑤中,已“冷却至室温”的判断依据是:_____________;
(9)量筒中,加装的长导管的作用是:______________;
(10)实验中,______________,则开始收集气体;
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(11)量筒的局部示意见图2,平视读数时应沿____________视线(选填“a”或“b”) 进行。图中________视线(选填“a”或“b”)对应的读数较大。

(12)若量筒中收集到气体的体积是224mL (己转化为标准状况下的数据),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数:_____________;[Mr(O2)=32、Mr(2Na2CO3·3H2O2)=314]
(13)经过讨论,小组同学一致认为测定结果偏大,理由是_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com