
| 44.12% |
| 12 |
| 8.82% |
| 1 |
| 47.06% |
| 16 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 27.2g |
| 136g/mol |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
| A、1H和3H的质子数相同,它们是同种核素 |
| B、6Li和7Li的质子数相等,电子数也相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、13C和14C属于同一种元素,它们的质量数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BrCl具有和卤素单质相似的化学性质 |
| B、BrCl和M反应时,BrCl即为氧化剂又为还原剂 |
| C、BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐 |
| D、将BrCl跟FeS04溶液反应.溶液会变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒平衡 | 平衡常数 | ||||
Fe3CO3(s)?Fe2+(aq)+CO
| Ksp=3.2×10-11 | ||||
H2CO3?H++HCO
| Ka1=4.36×10-7 | ||||
HCO
| Ka2=4.68×10-11 | ||||
2HCO
| K=1.3×-4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
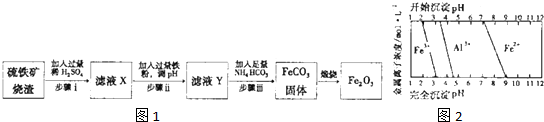
 铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com