
【题目】为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用。
(1)下列说法正确的是__________(填序号)。
A. CH4与CO2分子均为含有极性共价键的非极性分子 B. 第一电离能:O>N>C
C. 沸点高低:CH4>SnH4>GeH4>SiH4 D. CH![]() 离子的空间构型为平面正三角形
离子的空间构型为平面正三角形
(2)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为__________。
②与CO互为等电子体的阴离子的电子式为__________,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有σ键的数目为__________。
(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。
①CH3COOH中C原子轨道杂化类型为__________;
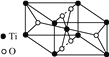
②钛氧化物晶胞结构如图所示,写出其化学式:__________。
【答案】 AD 1s22s22p63s23p63d84s2或[Ar]3d84s2 [∶CN∶]-或[∶CC∶]2- 8 mol或8×6.02×1023 sp3、sp2 TiO2
【解析】(1)A、CH4分子中含有极性共价键C-H,空间构型为正四面体结构,为非极性分子,CO2 中C=O为极性键,二氧化碳为直线型,是非极性分子,故A正确;B、同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:N>O>C,故B错误;C.CH4、SnH4、GeH4、SiH4属于都不含有氢键的分子晶体,相对分子质量大的沸点高,所以沸点高低:SnH4>GeH4>SiH4>CH4,故C错误;D、CH3+离子的价层电子对数=![]() =3,为sp2杂化,故D正确;故选AD;①Ni的原子序数为28,根据能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2 ;②CO分子中含有2个原子、价电子数是10,与CO互为等电子体的与CO互为等电子体的阴离子微粒有CN-或C22-,其电子式为 [∶CN∶]-或[∶CC∶]2-,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,8×6.02×1023 ;(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,②该晶胞中氧原子个数为4×1/2+2=4,钛原子个数=8×1/8+1=2,所以化学式为TiO2。
=3,为sp2杂化,故D正确;故选AD;①Ni的原子序数为28,根据能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2 ;②CO分子中含有2个原子、价电子数是10,与CO互为等电子体的与CO互为等电子体的阴离子微粒有CN-或C22-,其电子式为 [∶CN∶]-或[∶CC∶]2-,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,8×6.02×1023 ;(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,②该晶胞中氧原子个数为4×1/2+2=4,钛原子个数=8×1/8+1=2,所以化学式为TiO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:3SiCl4 +2N2 +6H2![]() Si3N4 +12HCl。
Si3N4 +12HCl。
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于_____________晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是______________(填写元素符号);属于非极性分子的化合物的电子式是__________。
(2)比较Si和Cl两种元素非金属性强弱的方法是__________。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为_________________(简述理由),写出Si与强碱溶液反应的离子反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是 ( )
A. BF4-为正四面体形
B. CO2为直线形
C. HCN为折线形(V形)
D. SO32-为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
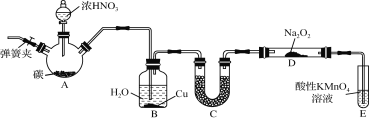
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀。
A.①④⑤B.②③④C.②③⑤D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
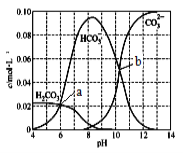
A. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
B. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- )
C. 25℃时,碳酸的第一步电离常数Ka1=10-7
D. 溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com