
| 探究内容 | 实验方案 | 实验现象 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O?2Al(OH)3↓+CO32- |
| B、NaHCO3溶液中滴加过量Ca(OH)2溶液:Ca2++OH-+HCO3-?CaCO3↓+H2O |
| C、硫酸铝溶液中加入过量氨水:Al3++4NH3?H2O?AlO2-+4NH4++2H2O |
| D、NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-?BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
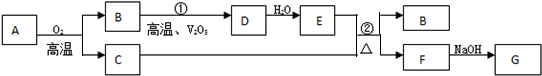
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、HF>HNO2>HCN |
| D、无法判断酸性强弱顺序 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入amolB,达到新平衡时,气体的总物质的量等于2a | ||
D、若温度不变时将压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2 | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78 | 140 | 难溶于水 |
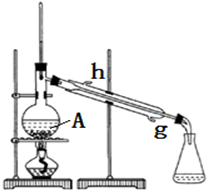
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于7 | B、小于7 |
| C、等于7 | D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com