
| A. | ①②③④ | B. | ②③④ | C. | ①②④ | D. | 全部 |
分析 ①氯水久置后,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
②氨水中一水合氨电离显碱性;
③浓硫酸具有脱水性;
④SO2通入品红溶液,体现其漂白性.
解答 解:①氯水久置后,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,最终为盐酸溶液,则浅黄绿色消失,故正确;
②氨水中一水合氨电离显碱性,遇酚酞溶液为红色,故正确;
③浓硫酸具有脱水性,则蔗糖中加入浓硫酸搅拌,最终为黑色的C,故错误;
④SO2通入品红溶液,体现其漂白性,红色褪去,故正确;
故选C.
点评 本题考查物质的性质及现象,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
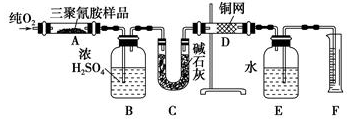
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )
25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )| A. | 由图可知HA为强酸 | |
| B. | 滴定终点应为于OA段之间 | |
| C. | A点对应溶液中:c(A-)=c(Na+) | |
| D. | 当滴入NaOH溶液10mL时,所得溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| B. | 1 mol CnH2n+2分子中含共价键数目为(3n+1)NA | |
| C. | 含NA个氧原子的O2与含NA个氧原子的O3的质量比为2:3 | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与盐酸发生中和反应 OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸溶液发生中和反应 2OH-+2H+═2H2O | |
| C. | 稀盐酸滴在大理石上 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向氯化钠溶液中滴加硝酸银溶液 Cl-+Ag+═AgCl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com