
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
分析 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高到0,以此来分析.
解答 解:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高到0,
A.Cu(IO3)2得电子作氧化剂,Cu(IO3)2中的铜和碘元素得电子化合价降低而被还原,故A正确;
B.Cu(IO3)2中Cu元素的化合价由+2价降低为+1价为氧化剂,所以CuI只是还原产物,故B错误;
C.有方程式得出,24KI参与反应,22个KI升高生成11个碘单质作还原剂被氧化发生氧化反应,所以每生成1molCuI,则有12molKI参与反应,即11molKI发生氧化反应,故C错误;
D.Cu(IO3)2中Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,所以1molCu(IO3)2参与反应共转移11mol电子,所以每转移1.1 mol电子,有0.1molCu(IO3)2参与反应,有0.2 mol$\stackrel{+5}{I}$得电子被还原,故D错误;
故选:A.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意Cu(IO3)2中碘元素有两种还原产物,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
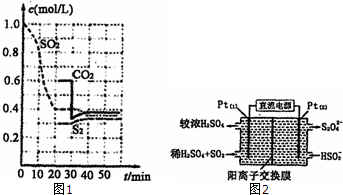 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在乙醇的液面上游动 | B. | 钠块并不熔化 | ||
| C. | 钠块沉在乙醇液面下面 | D. | 钠块表面有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com