
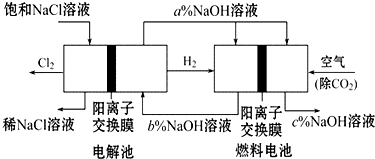
 有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:
有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:分析 (1)燃料电池中,通入空气的电极使正极,发生得电子的还原反应,燃料电池中阳离子从负极流向正极;
(2)①电解池的阴极上是氢离子得电子的还原反应;
②当阴极上收集到标准状况下气体22.4L时,物质的量为1mol,阴极电极反应式为:2H++2e-═H2↑,1mol转移2mol的电子;
(3)根据电池中的电子守恒进行计算即可;
(4)电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,说明生成的氯气和生成的氢氧化钠溶液恰好完全反应生成次氯酸钠,依据原子守恒配平书写化学方程式.
解答 解:(1)燃料电池中,通入空气的电极是正极,发生得电子的还原反应:O2+2H2O+4e-=4OH-,通燃料氢气的电极是负极,阳离子的移动方向是从负极流向正极,即从左向右,负极反应式为:H2-2e-+2OH-=2H2O,
故答案为:正极;从左向右;H2-2e-+2OH-=2H2O;
(2)①电解氯化钠溶液,电解池的阴极上是氢离子得电子的还原反应,即2H2O+2e-=H2↑+2OH-(或2H++2e-═H2↑),
故答案为:2H2O+2e-=H2↑+2OH-(或2H++2e-═H2↑);
②当阴极上收集到标准状况下气体22.4L时,物质的量为1mol,阴极电极反应式为:2H++2e-═H2↑,1mol转移2mol的电子,所以电路中通过的电子的数目为2NA,
故答案为:2;
(3)电解池中,阳极反应:2Cl--2e-=Cl2↑,产生2molCl2,转移电子是4mol,燃料电池中,正极发生得电子的还原反应:O2+2H2O+4e-=4OH-,当转移4mol电子,理论上燃料电池中消耗O2的物质的量为1mol,故答案为:1;
(4)电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,说明生成的氯气和生成的氢氧化钠溶液恰好完全反应生成次氯酸钠,反应的化学方程式为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑,故答案为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑.
点评 本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注意利用电子守恒进行计算,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NO在反应中作还原剂 | |
| B. | 氧化剂和还原剂的物质的量比为1:3 | |
| C. | FeCl2发生还原反应 | |
| D. | 0.5molFeCl2发生反应,转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高反应温度 | B. | 保持容积不变,充入NO2 | ||
| C. | 保持容积不变,充入He | D. | 保持压强不变,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑧ | B. | ⑤⑥⑦⑧ | C. | 均不可 | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com