
典型元素及化合物的特征性质
(1)Na、Al、Fe、Cu四种元素的单质中:
①能与水剧烈反应的是____________,反应的离子方程式:
________________________________________________________________________;
②能与NaOH溶液反应的是________,反应的离子方程式:
________________________________________________________________________,
其中作氧化剂的是______________________________________________________________;
③Cu在潮湿的空气中被腐蚀的化学方程式:
________________________________________________________________________;
④与氧气反应条件不同,反应产物不同的是
________________________________________________________________________。
(2)上述四种金属的氧化物中:
①能用作供氧剂的是________,写出一个化学方程式:
________________________________________________________________________;
②既能溶于酸溶液又能溶于强碱溶液的是______________________________________,
离子方程式分别为__________________,______________________________________;
③常温下为黑色固体的是____________________________________________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的是__________,现象_____________________________________,
反应的化学方程式为_________________________________________________________;
②具有两性的是___________________________________________________________。
(4)上述四种金属形成的阳离子共有________种,其中既能表现还原性,又能表现氧化性的是________,检验Fe2+的方法是__________________________________;其中氧化性最强的是________,它腐蚀金属铜的离子方程式为______________________________。
答案 (1)①Na 2Na+2H2O===2Na++2OH-+H2↑
②Al 2Al+2OH-+2H2O===2AlO +3H2↑ H2O
+3H2↑ H2O
③2Cu+CO2+H2O+O2===Cu2(OH)2CO3
④Na、Fe
(2)①Na2O2 2Na2O2+2CO2===2Na2CO3+O2或2NaO2+2H2O===4NaOH+O2↑
②Al2O3 Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO +H2O
+H2O
③FeO、Fe3O4、CuO
(3)①Fe(OH)2 白色沉淀迅速变为灰绿色最后变为红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)3
②Al(OH)3
(4)6 Fe2+、Cu+ 先加KSCN溶液不显红色,再加H2O2溶液变血红色 Fe3+ 2Fe3++Cu===2Fe2++Cu2+


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)物质发生化学变化时,物质的总能量和总质量保持不变( )
(2)化学变化中一定同时存在着化学键的断裂和形成( )
(3)在化学变化中分子和原子的种类及数目都不发生变化( )
(4)电解质溶液导电时,必然伴随着化学变化( )
(5)化学变化中常伴随着发光、放热和颜色变化,因而有发光、放热和颜色变化的变化一定是化学变化( )
(6)铁粉加入FeCl3溶液中的反应既属于化合反应,又属于离子反应,还属于氧化还原反应( )
(7)氢氧根离子的电子式:[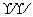

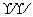 H]-( )
H]-( )
(8)乙烯的结构简式:CH2CH2( )
(9)明矾的化学式:Al2(SO4)3·12H2O( )
(10)PM2.5在空气中形成气溶胶( )
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列几个变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3;③Na2SiO3 →Na2 CO3;④
CO3;④
Ca(NO3)2→CaSiO3,其中不能通过一步反应实现的是 ( )
A.①② B.②④ C.③④ D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是 ( )
A.CaCO3属于碳酸盐
B.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物
D.通过化学反应,可由Ba(OH)2一步转化生成NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子的氧化性或还原性等因素有关。经过查阅资料可知,CuS在水中的溶解度很小,在稀酸溶液中也不溶解;Fe2S3在水中的溶解度更小,但却能溶于稀酸。下列有关说法正确的是( )
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH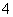 和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+、S
D.Fe3+的氧化性比Cu2+的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
菱锰矿的主要成分是MnCO3(含有少量FeS2、Al2O3),以菱锰矿为原料制备锰单质的流程如下所示:

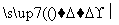 浆化
浆化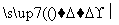 溶液1
溶液1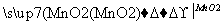 溶液2
溶液2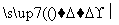 精制—→电解—→Mn
精制—→电解—→Mn
请回答下列问题:
(1)菱锰矿在浸取前需要粉碎,其目的是______________________________。
(2)用稀硫酸浸取时,主要反应的离子方程式为____________;加入二氧化锰时被氧化的物质是____________(填化学式)。
(3)已知Fe、Al、Mn的氢氧化物开始沉淀及沉淀完全时的pH如表所示,则加氨水沉淀时应控制溶液的pH范围为______________。此时得到的沉淀是____________、__________(填化学式)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 1.8 | 4.1 | 8.3 |
| 完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)电解硫酸锰溶液时,阴极的电极反应式为____________________。用酸性高锰酸钾溶液检验Mn2+,产生黑色沉淀,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下纯水的pH=6。
(1)pH=7的溶液呈__________(填“酸性”“中性”或“碱性”);
(2)该温度下0.1 mol·L-1的盐酸溶液的pH=__________;
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH=-2 834.9 kJ·mol-1①
Fe2O3(s)+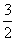 C(s)===
C(s)===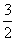 CO2(g)+2Fe(s)
CO2(g)+2Fe(s)
ΔH=+234.1 kJ·mol-1②
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1③
写出铝与氧化铁发生铝热反应的热化学方程式________________________________________________________________________。
(2)已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1①
N2(g)+3H2(g)===2NH3(g)
ΔH=-92.4 kJ·mol-1②
2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1③
若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com