
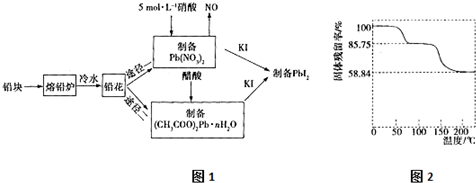
分析 用废铅块为原料合成PbI2的流程:为了增大与酸反应的接触面积,加快溶解反应速率,将铅块制成铅花,途径一:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,Pb(NO3)2+2KI=PbI2↓+2KNO3,途径二:Pb(NO3)2+2CH3COOH+nH2O=(CH3COO)2Pb•nH2O+2HNO3,(CH3COO)2Pb•nH2O+2KI=PbI2↓+2CH3COOK+nH2O.
(1)根据影响反应速率的因素去分析,接触面积越大,反应速率越快,铅块制成铅花为了增大表面积,加快反应速率;反应温度高,能加快反应速率,但制备硝酸铅得原料之一硝酸易分解,易挥发,通过途径二的原料乙酸也易挥发;
(2)铅和稀硝酸反应生成硝酸铅、一氧化氮和水,据此书写化学方程式;铅和浓硝酸反应生成硝酸铜,二氧化氮和水,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多;
(3)①样品在75℃时已完全失去结晶水,(CH3COO)2Pb•nH2O在0~75℃反应生成乙酸铅和水,可假设起始固体质量为100g,则加热到75℃时完全失去结晶水的质量就是固体减轻的质量,求算出水的物质的量及醋酸铅的物质的量,根据两者的物质的量之比可确定n的值,据此写出这个温度区间内反应的化学方程式;
②醋酸铅继续加热分解剩余固体为铅的氧化物,可根据剩余固体质量及铅、碳原子守恒来确定有机物的摩尔质量,推测有机物的分子组成;
(4)根据Ksp(PbI2)=c(Pb2+)•c2(I-)=4c3(Pb2+)结合Ksp(PbI2)=4.0×10-9计算c(Pb2+).
解答 解:(1)接触面积越大,反应速率越快,将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,途径二:Pb(NO3)2+2CH3COOH+nH2O=(CH3COO)2Pb•nH2O+2HNO3,(CH3COO)2Pb•nH2O+2KI=PbI2↓+2CH3COOK+nH2O,原料乙酸易挥发,温度过高,会加快挥发,
故答案为:增大反应物的接触面积,加快反应速率;温度过高,导致HNO3挥发分解、CH3COOH挥发;
(2)铅具有还原性,硝酸具有强氧化性,铅和稀硝酸反应生成硝酸铅、一氧化氮和水,化学方程式为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,铅与浓硝酸发生氧化还原反应,生成硝酸铅,二氧化氮和水,反应的化学方程式为Pb+4HNO3(浓)=Pb(NO3)2+2NO2↑+2H2O,与稀硝酸相比,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多,
故答案为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多;
(3)①假设样品的起始质量为100克,根据固体残留率的公式可知,75℃时剩余固体为87.75克,样品在75℃时已完全失去结晶水,生成的水质量为100g-87.75g=12.25g,则醋酸铅与水的物质的量之比为$\frac{85.75g}{325g/mol}$:$\frac{12.25g}{18g/mol}$=1:3,则n=3,则反应方程式为:(CH3COO)2Pb•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$(CH3COO)2Pb+3H2O,
故答案为:(CH3COO)2Pb•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$(CH3COO)2Pb+3H2O;
②铅的氧化物质量为58.84克,醋酸铅的物质的量为=$\frac{85.75g}{325g/mol}$=$\frac{85.75}{325}$mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为$\frac{85.75}{325}$mol,此氧化物的摩尔质量为
58.84g÷$\frac{85.75}{325}$mol=223g/mol,为PbO,有机物的质量为85.75g-58.84g=26.91g,此有机物分子内应含有四个碳原子,物质的量为$\frac{85.75}{325}$mol,摩尔质量为26.91g÷$\frac{85.75}{325}$mol=102,根据原子守恒可知有机物的分子式为C4H6O3,结构简式为(CH3CO)2O;
故答案为:(CH3COO)2Pb $\frac{\underline{\;100~200℃\;}}{\;}$PbO+(CH3CO)2O;
(4)Ksp(PbI2)=c(Pb2+)•c2(I-)=4c3(Pb2+)=4.0×10-9,所以c(Pb2+)=1.0×10-3,
故答案为:1.0×10-3.
点评 本题考查制备实验方案设计,为高频考点,涉及反应速率影响因素、难溶物溶解平衡、溶度积计算等知识点,侧重考查学生分析计算能力,注意(3)题的有关计算和分析,为难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用无水硫酸铜可检验酒精中是否有水 | |
| B. | 加生石灰进行过滤,可除去酒精中的水 | |
| C. | 用酒精可萃取出碘水中的碘 | |
| D. | 医院用100%酒精进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
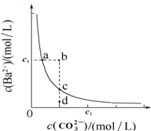
| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
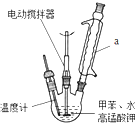 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下: $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$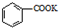 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$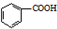
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
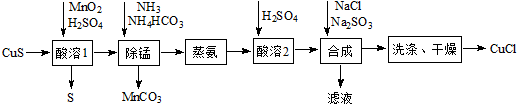
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+、Na+、AlO2-、CO32- | B. | 二氧化硫:Na+、NH4+、SO32-、Cl- | ||
| C. | 氯化氢:H+、K+、MnO4-、SO42- | D. | 二氧化碳:Mg2+、Al3+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com