
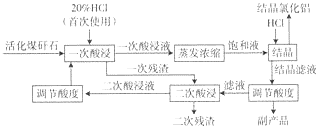
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
分析 以煤矸石(含有Al203、Fe203及Si02等)为原料制备结晶氯化铝,煤矸石加入20%的盐酸溶解后,Al203、Fe203和盐酸反应得到氯化铝、氯化铁溶液,Si02和盐酸不反应,过滤得到一次残渣为Si02,二次酸浸继续发生如上的反应使氧化铝、氧化铁尽可能溶解,过滤得到二次酸浸液和二次滤渣,二次滤液调节溶液PH重新提取,一次性酸浸液蒸发浓缩制备饱和溶液,在氯化氢气流中得到氯化铝晶体,结晶的滤液主要是氯化铝、氯化铁、盐酸,调节溶液酸度析出沉淀滤液进行二次酸浸进入循环使用提纯的过程,
(1)结晶滤液的主要成分是氯化铝、氯化铁、盐酸,二次残渣的主要成分是二氧化硅;
(2)该工艺流程中可以循环使用的物质是参与反应过程,最后又生成的物质,充分利用原料,杂质的富集可能会影响氯化铝的纯度;
(3)配平氧化还原反应的离子方程式.结合反应定量关系计算铁元素的质量分数,5Fe2++Mn04-+8H+=5Fe3++Mn2++4H20,注意溶液体积的变化;
(4)图中数据分析可知AICl3结晶效率随氯化氢体积增大,氯化氢利用率降低,氯化铝的溶解度会随盐酸浓度增大减小;
(5)结晶氯化铝( AICl3•6H20)加入一定量蒸馏水,在lOO℃水浴中加热蒸干即可得到聚合氯化铝[Al2(OH)nCl6-n•H20]m,依据原子守恒配平书写化学方程式;
解答 解:以煤矸石(含有Al203、Fe203及Si02等)为原料制备结晶氯化铝,煤矸石加入20%的盐酸溶解后,Al203、Fe203和盐酸反应得到氯化铝、氯化铁溶液,Si02和盐酸不反应,过滤得到一次残渣为Si02,二次酸浸继续发生如上的反应使氧化铝、氧化铁尽可能溶解,过滤得到二次酸浸液和二次滤渣,二次滤液调节溶液PH重新提取,一次性酸浸液蒸发浓缩制备饱和溶液,在氯化氢气流中得到氯化铝晶体,结晶的滤液主要是氯化铝、氯化铁、盐酸,调节溶液酸度析出沉淀滤液进行二次酸浸进入循环使用提纯的过程,
(1)结晶滤液的主要成分是氯化铝、氯化铁、盐酸,化学式为:AlCl3、FeCl3和HCl,二次残渣的主要成分是二氧化硅,化学式为:SiO2,
故答案为:AlCl3、FeCl3和HCl,SiO2;
(2)该工艺流程中可以循环使用的物质是参与反应过程,最后又生成的物质,分析过程可知HCl符合可以循环使用,循环利用该物质的优点是充分利用原料降低成本,缺点是杂质的富集可能会影响后续AlCl3•6H2O产品的纯度,
故答案为:盐酸,充分利用原料降低成本,杂质的富集可能会影响后续AlCl3•6H2O产品的纯度;
(3)某同学称取5.000g二次残渣,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液,然后移取25.00mL用1.000×l0-2mol•L-lKMn04标准溶液滴定,消耗标准溶液20.00mL.
5Fe2++Mn04-+8H+=5Fe3++Mn2++4H20
5 1
n 0.020L×1.000×l0-2mol•L-l
n=0.001mol
100mL溶液中含铁元素物质的量=0.001mol×$\frac{100}{25}$=0.004mol
二次残渣中铁元素的质量分数=$\frac{0.004mol×56g/mol}{5.000g}$×100%=4.480%,
故答案为:4.480%;
(4)图中数据分析可知AICl3结晶效率随氯化氢体积增大,氯化氢利用率降低,氯化铝的溶解度会随盐酸浓度增大减小,结晶效率变化的原因是氯化铝的溶解度会随着溶液中盐酸浓度的增加而下降,随HC1体积的增大,HC1利用率降低的原因可能是通入的HCl 气体使溶液中的盐酸浓度升高,继续通入HCl 气体,降低了气体在溶液中的吸收效率,
故答案为:氯化铝的溶解度会随着溶液中盐酸浓度的增加而下降,通入的HCl 气体使溶液中的盐酸浓度升高,继续通入HCl 气体,降低了气体在溶液中的吸收效率;
(5)结晶氯化铝( AICl3•6H20)加入一定量蒸馏水,在lOO℃水浴中加热蒸干即可得到聚合氯化铝[Al2(OH)nCl6-n•H20]m,依据原子守恒配平书写化学方程式为:2AlCl3•6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Al2(OH)nCl6-n+nHCl+(12-n)H2O
故答案为:2AlCl3•6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Al2(OH)nCl6-n+nHCl+(12-n)H2O;
点评 本题考查了物质分离提纯的实验过程分析判断,数据分析和不和规律的理解应用,物质性质和题干信息的应用是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
、C .反应④所用试剂和条件是氢氧化钠醇溶液、加热.
.反应④所用试剂和条件是氢氧化钠醇溶液、加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及 离子方程式 | 评 价 |
| A | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2: MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | 错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3═2Al3++3H2+3 CO32- | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
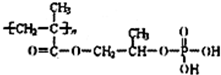
 ,该反应类型是酯化反应.
,该反应类型是酯化反应.
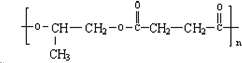
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2能与碱反应 | Cl2可用于制漂白粉 |
| B | Si有导电性 | SiO2可用于制光导纤维 |
| C | N2性质稳定 | N2可作为食品保护气 |
| D | 锌的金属性比铁强 | 轮船外壳上焊接若干锌块以减缓其腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com