
【题目】按要求书写热化学方程式(是离子反应的也可用离子方程式表示).
(1)表示强酸和强碱中和热的热化学方程式: .
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式: .
(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式: . 若1g水蒸气转化成液态水放热2.5kJ,则反应H2(g)+ ![]() O2(g)═H2O的△H=kJmol﹣1 , H2的燃烧热为 .
O2(g)═H2O的△H=kJmol﹣1 , H2的燃烧热为 .
【答案】
(1)H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ?mol﹣1
(2)N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣644kJ?mol﹣1
(3)H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJ/mol;﹣286.8;286.8 kJ?mol﹣1
O2(g)═H2O(g)△H=﹣241.8kJ/mol;﹣286.8;286.8 kJ?mol﹣1
【解析】(1)稀溶液中酸、碱反应生成1mol水放出的热量为中和热,强酸、强碱反应中和热△H=﹣57.3kJmol﹣1 , 表示强酸和强碱中和热的热化学方程式:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJmol﹣1 ,
所以答案是:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJmol﹣1;(2)发生反应:N2H4+2H2O2=N2+4H2O,生成4mol水放出的热量为161kJ×4=844kJ,故该反应热化学方程式为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣644kJmol﹣1 , 所以答案是:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣644kJmol﹣1;(3)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣241.8kJ/mol;
O2(g)=H2O(g)△H=﹣241.8kJ/mol;
1g水蒸气转化成液态水时放热2.5kJ,1mol水蒸气转化为液态水放出的热量为 ![]() ×2.5kJ=45kJ,故生成1mol液态水放出的热量为241.8kJ+45kJ=286.8kJ,故H2(g)+
×2.5kJ=45kJ,故生成1mol液态水放出的热量为241.8kJ+45kJ=286.8kJ,故H2(g)+ ![]() O2(g)═H2O(l)的反应热△H=﹣286.8kJ/mol,
O2(g)═H2O(l)的反应热△H=﹣286.8kJ/mol,
氢气燃烧热为286.8kJmol﹣1 , 所以答案是:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣241.8kJ/mol;﹣286.8;286.8kJmol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ/mol;﹣286.8;286.8kJmol﹣1


科目:高中化学 来源: 题型:
【题目】以下有关物质结构的描述正确的是( )
A. 甲苯分子中的所有原子可能共平面
B. 苯乙烯分子中的所有原子不可能共平面
C. 二氯甲烷分子为正四面体结构
D. 乙烷分子中的所有原子不可能共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( ) 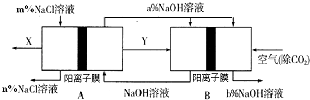
A.X为H2 , Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a>b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质发生化学变化不一定都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的容器中加入1.5 mol氙气(Xe)和7.5 mol氟气(F2),于400 ℃和2633 kPa压强下加热数小时,然后迅速冷却至25 ℃,容器内除得到一种无色晶体外,还有4.5 mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是( )
A. 1∶2 B. 1∶3 C. 1∶4 D. 1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨苄青霉素是高效、广谱和低毒的抗生素,其结构简式如图所示.下列说法不正确的是( ) 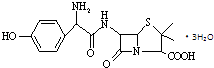
A.羟氨苄青霉素在空气中不能稳定存在
B.每个羟氨苄青霉素分子中含有3个手性碳原子
C.羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应
D.1mol羟氨苄青霉素与氢氧化钠溶液反应时,最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉. Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(gL﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
Ⅱ.处理方案:
(1)步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2. 此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是 .
(2)步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤. ①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式: .
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式: .
③此步骤中必须控制好NaClO溶液的用量,其原因可能是 .
(3)步骤3:回收镍 以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是: .
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.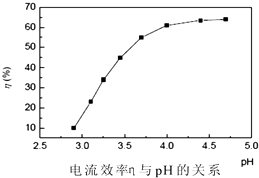
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)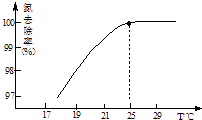
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层含有的能级数为n(n为能层序数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com