
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
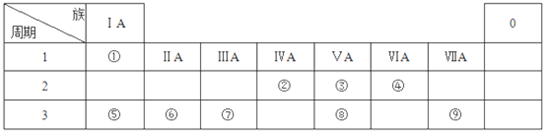
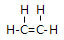 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为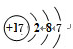 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 往花生油中加入稀硫酸能发生皂化反应 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

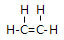 ;由元素④和元素②形成的化合物的电子式为
;由元素④和元素②形成的化合物的电子式为 ;元素⑦的原子结构示意图为
;元素⑦的原子结构示意图为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com