
 、
、 ;
;分析 D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体,则D为S元素;A单质在B单质中燃烧发出苍白色火焰,即为H2、Cl2,则A是H元素、B是Cl元素;C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层数相同,且最外层电子数之差为奇数,故C为Mg,据此答题.
解答 解:D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体,则D为S元素;A单质在B单质中燃烧发出苍白色火焰,即为H2、Cl2,则A是H元素、B是Cl元素;C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层数相同,且最外层电子数之差为奇数,故C为Mg,
(1)通过以上分析知,A、B、C、D分别是H、Cl、Mg、S元素,
故答案为:H;Cl;Mg;S;
(2)H离子核外没有电子,Cl、S简单离子核外电子数是18,镁离子核外电子数是10,所以离子的电子层结构相同的两种元素是Cl、S,其离子结构示意图分别为 、
、 ,
,
故答案为:Cl、S; 、
、 ;
;
(3)A、B、C、D四种元素中能形成AB型共价化合物为HCl,所以涉及的元素为H、Cl,
故答案为:H、Cl.
点评 本题考查了原子结构和性质,根据原子核外电子排布及物质的性质确定元素,知道原子生成离子时变化的量和不变的量,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
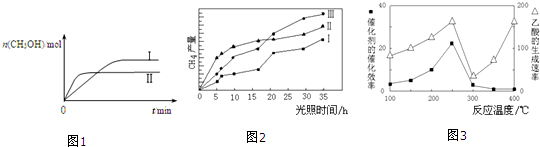
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
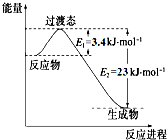 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | NaOH溶液、溴水 | ||
| C. | 高锰酸钾溶液、溴水 | D. | NaHCO3溶液、溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
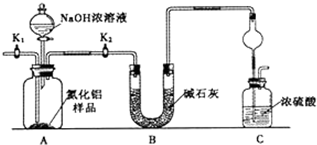

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com