
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:4 B.1:2 C.2:1 D.4:1
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 11-2 有机物的结构分类和命名练习卷(解析版) 题型:选择题
分子式为C7H7Cl,且结构中含有苯环的有机化合物的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-3 常见气体的制备练习卷(解析版) 题型:选择题
用下图所示装置进行实验,下表中实验结果能说明结论的是( )
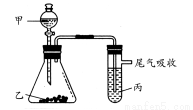
甲乙丙结论
A水电石溴水稳定性:水>C2H2>Br2
B盐酸石灰石苯酚钠溶液酸性:HCl>H2CO3>苯酚
C盐酸FeS溴水还原性:S2->Br->Cl-
D浓盐酸KMnO4KBr溶液氧化性:KMnO4<Cl2<Br2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
下列关于离子检验的说法中正确的是( )
A.向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32-
B.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl-
C.向某溶液中加入盐酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:填空题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A.Na2S2O3 B.AlCl3
C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1:6
②Fe2O3+2Al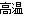 Al2O3+2Fe;1:2
Al2O3+2Fe;1:2
③SiO2+3C=SiC+2CO↑;1:2
④3NO2+H2O=2HNO3+NO;2:1
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
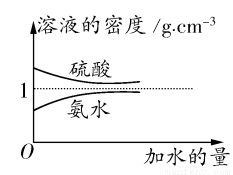
| 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与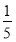 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度 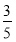 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:填空题
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:填空题
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶的白色固体,E则易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
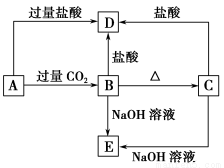
(1)写出化学式:A ,B ,C ,D ,E 。
(2)写出下列反应的离子方程式:
A→B: ;
A→D: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com