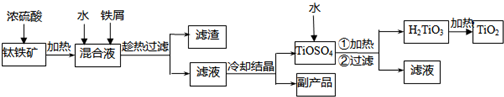
解:(1)铁钛矿加入浓硫酸后生成Fe
3+离子,加入铁将Fe
3+还原为Fe
2+,以生成FeSO
4?7H
2O,
故答案为:将Fe
3+还原为Fe
2+;
(2)加入过量铁屑后溶液中含有Fe
2+离子,则过滤后可得FeSO
4?7H
2O(或FeSO
4),滤渣为过量的铁屑和不溶物脉石,
故答案为:FeSO
4?7H
2O(或FeSO
4),铁屑和脉石;
(3)TiOSO
4的水解的水解为吸热反应,加热可促进TiOSO
4的水解,故答案为:促进TiOSO
4的水解;
(4)由以上反应可知,反应后生成Fe
2+离子,为2.5mol.根据溶液呈电中性可知,2n(TiO
2+)+2n(Fe
2+)+n(H
+)=2n(SO
42-),n(H
+)=2×4.75mol-2×2mol-2×2.5mol=0.5mol,
c(H
+)=
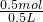
=1mol/L,PH=0,
故答案为:pH=0;
(5)为防止碳与氧气反应,应可绝空气加热,平衡常数等于反应物气体的浓度幂之积除以反应物气体的浓度幂之积,则K=
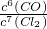
,反应后生成气体和液体,混乱度增大,所以△S>0,
故答案为:隔绝空气,K=
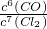
,△S>0;
(6)熔炼后为液体和固体的混合物,应用过滤的方法分离,检验Fe
3+利用Fe
3+离子与KSCN反应生成红色Fe(SCN)
3,反应的离子方程式为Fe
3++3SCN
-=Fe(SCN)
3,
故答案为:过滤;Fe
3++3SCN
-=Fe(SCN)
3.
分析:(1)铁钛矿加入浓硫酸后生成Fe
3+离子,加入铁将Fe
3+还原为Fe
2+;
(2)加入过量铁屑后溶液中含有Fe
2+离子,则过滤后可得FeSO
4?7H
2O(或FeSO
4),滤渣为过量的铁屑和不溶物脉石;
(3)根据影响水解的外界条件分析;
(4)未知阳离子为Fe
2+,根据溶液的电中性原则分析;
(5)为防止碳与氧气反应,应可绝空气加热,根据平衡常数等于反应物气体的浓度幂之积除以反应物气体的浓度幂之积计算平衡常数,根据混乱度的大小判断△S;
(6)根据物质的存在状态选择分离方法,利用铁离子与KSCN反应生成红色物质鉴别.
点评:本题考查化学工艺流程,题目难度较大,做题时注意从物质的性质角度结合题中信息解答,本题易错点为(3)和(4)两项.

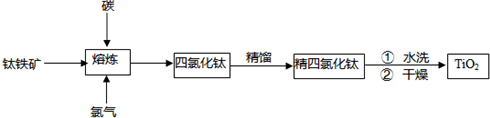
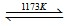 2TiCl4(l)+2FeCl3(s)+6CO(g)
2TiCl4(l)+2FeCl3(s)+6CO(g)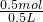 =1mol/L,PH=0,
=1mol/L,PH=0,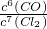 ,反应后生成气体和液体,混乱度增大,所以△S>0,
,反应后生成气体和液体,混乱度增大,所以△S>0,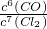 ,△S>0;
,△S>0;

 阅读快车系列答案
阅读快车系列答案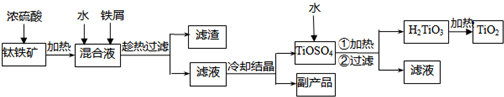
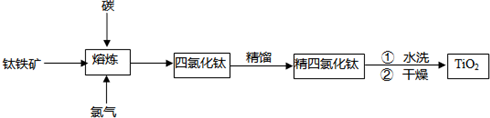
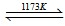 2TiCl4(l)+2FeCl3(s)+6CO(g)
2TiCl4(l)+2FeCl3(s)+6CO(g)
 2TiCl4(l)+2FeCl3(s)+6CO(g)
2TiCl4(l)+2FeCl3(s)+6CO(g)