
| n |
| V |
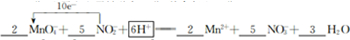 ,
,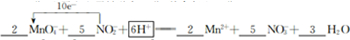 ;
;| 7.9g |
| 158g/mol |
| 10 |
| 100 |
| 5 |
| 2 |
| 0.0125mol |
| 0.02L |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 选项 | 甲 | 乙、丙、丁 |
| ① | 干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 合金 | 不锈钢、青铜、生铁 |
| ③ | 胶体 | 稀豆浆、血液、淀粉溶液 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 电解质 | 水、冰醋酸、四氯化碳 |
| A、②③④ | B、①②③④ |
| C、①②④⑤ | D、①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的浓度相等 |
| B、N2、H2、NH3的浓度不再发生变化 |
| C、反应停止 |
| D、N2、H2、NH3在容器中共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属的腐蚀在生产、生活中很常见,请回答以下问题.
金属的腐蚀在生产、生活中很常见,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-丁烯 |
| B、2-甲基-1,3-丁二烯 |
| C、1-丁炔 |
| D、2-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com