
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体②液态HCl③CO2 ④汞⑤CaCO3固体⑥稀硫酸⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水,其中属于电解质的是(填序号,下同)___________;属于非电解质的是____________;能导电的有__________。
(2)已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br。在含有 FeI2和 FeBr2的溶液中通入少量 Cl2,则最先被氧化的离子是_____,I、Br、Fe2+还原性由强到弱的顺序为:___________。
(3)实验室里盛装NaOH溶液试剂瓶用橡皮塞或软木塞,而不用玻璃塞。用化学方程式解释:_________________________________________________
(4) 0.3mol氨气和0.4mol二氧化碳的质量之比___________,所含分子数之比______________,所含原子数之比____________。
【答案】①②⑤⑧ ③⑦ ④⑥⑧⑨ I I>Fe2+ >Br 2NaOH+ SiO2== Na2SiO3+ H2O 51:176 3:4 1:1
【解析】
(1)在水溶液里或熔融状态下能导电的化合物是电解质;在水溶液里和熔融状态下都不导电的化合物是非电解质;含有自由移动的电子或阴阳离子的物质就能导电;
(2)还原剂的还原性大于还原产物;
(3)玻璃中含有二氧化硅,二氧化硅是酸性氧化物,可以和氢氧化钠反应生成硅酸钠;
(4)计算氨气和二氧化碳的质量、原子数即可。
(1)①![]() 晶体是化合物,溶于水和熔融状态下都能导电,是电解质,阴、阳离子不自由移动,所以不能导电;②液态
晶体是化合物,溶于水和熔融状态下都能导电,是电解质,阴、阳离子不自由移动,所以不能导电;②液态![]() 是化合物,溶于水能导电,是电解质,液态HCl中只存在分子,所以不导电;③
是化合物,溶于水能导电,是电解质,液态HCl中只存在分子,所以不导电;③![]() 是化合物,虽然其水溶液能导电,但导电的离子不是自身电离的,属于非电解质,只存在分子,所以不导电;④汞属于金属单质,既不是电解质也不是非电解质,金属单质可以导电;⑤CaCO3固体是化合物,溶于水和熔融状态下都能导电,是电解质,阴、阳离子不自由移动,所以不能导电;⑥稀硫酸是混合物,既不是电解质、也不是非电解质,含有自由移动的氢离子和硫酸根,能导电;⑦酒精是化合物,在水溶液和熔融状态下都不导电,属于非电解质;⑧熔融的
是化合物,虽然其水溶液能导电,但导电的离子不是自身电离的,属于非电解质,只存在分子,所以不导电;④汞属于金属单质,既不是电解质也不是非电解质,金属单质可以导电;⑤CaCO3固体是化合物,溶于水和熔融状态下都能导电,是电解质,阴、阳离子不自由移动,所以不能导电;⑥稀硫酸是混合物,既不是电解质、也不是非电解质,含有自由移动的氢离子和硫酸根,能导电;⑦酒精是化合物,在水溶液和熔融状态下都不导电,属于非电解质;⑧熔融的![]() 是化合物,溶于水和熔融状态下都能导电,是电解质,有自由移动的钠离子和氯离子,能导电;⑨浓氨水属于混合物,既不是电解质、也不是非电解质,含有自由移动的铵根和氢氧根离子,能导电;属于电解质的是①②⑤⑧;属于非电解质的是③⑦;能导电的是④⑥⑧⑨;
是化合物,溶于水和熔融状态下都能导电,是电解质,有自由移动的钠离子和氯离子,能导电;⑨浓氨水属于混合物,既不是电解质、也不是非电解质,含有自由移动的铵根和氢氧根离子,能导电;属于电解质的是①②⑤⑧;属于非电解质的是③⑦;能导电的是④⑥⑧⑨;
故答案为:①②⑤⑧;③⑦;④⑥⑧⑨;
(2)根据![]() ,碘离子是还原剂,亚铁离子是还原产物,故还原性:
,碘离子是还原剂,亚铁离子是还原产物,故还原性:![]() ,根据
,根据![]() ,亚铁离子是还原剂,溴离子是还原产物,故还原性:
,亚铁离子是还原剂,溴离子是还原产物,故还原性:![]() ,综上所述,还原性顺序:
,综上所述,还原性顺序:![]() ;在含有
;在含有![]() 和
和![]() 的溶液中通入少量
的溶液中通入少量![]() ,还原性强的先被氧化,即
,还原性强的先被氧化,即![]() 先被氧化,
先被氧化,
故答案为:![]() ;
;![]() ;
;
(3)玻璃中含有二氧化硅,二氧化硅和氢氧化钠反应生成的硅酸钠有黏性,能够将玻璃塞和瓶身粘在一起,方程式为:![]() ,
,
故答案为:![]() ;
;
(4)0.3mol氨气的质量是0.3mol×17g/mol=5.1g,0.4mol二氧化碳的质量是0.4mol×44g/mol=17.6g,故二者质量比为51:176;分子数之比即为物质的量之比,即3:4;0.3mol氨气含原子物质的量是1.2mol,0.4mol二氧化碳中含原子物质的量为1.2mol,故原子数之比为1:1,
故答案为: 51:176;3:4;1:1。


科目:高中化学 来源: 题型:
【题目】用X射线研究某金属晶体,测得在边长为360 pm的立方晶胞中含有4个金属原子,此时金属的密度为9.0 g/cm3。试回答下列问题:
(1)此金属晶胞属于哪一种类型?_______
(2)求每个晶胞的质量。_______
(3)求此金属的相对原子质量。_______
(4)求此金属原子的原子半径(pm)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用O2将HCl转化为Cl2,反应为:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。请完成下列填空:
2Cl2(g)+2H2O(g)。请完成下列填空:
(1)该反应化学平衡常数K的表达式为_____________________;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是_________反应(填“吸热”或者“放热”)。
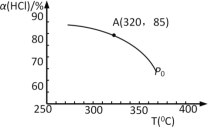
(2)写出一种能提高HCl转化率的方法___________________。
(3)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线______,并简要说明理由:_________________。
(4)根据图中信息所示,在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中n(HCl)=_____mol。
(5)氯元素能组成多种化合物,如常见的铵态氮肥,氯化铵溶液呈______性,其原因用离子方程式表示:___________________________。现有一瓶氯化铵、氯化钠和氨水的混合液,经测定溶液呈中性,此时三种离子的关系是:[Na+]+[NH4+]_____[Cl-](填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项 | 现象或事实 | 解释 |
A | Na2O2常用于潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C | FeCl3溶液可用于刻制印刷铜电路板 | FeCl3可与Cu发生反应 |
D | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | 烧菜时铁锅被染色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
A. Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
B. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
C. 已知25 ℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×104
Fe3++3H2O的平衡常数K=4.0×104
D. 已知25 ℃时Ksp[Mg(OH)2] =1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A.NH4HCO3溶液中加入过量的NaOH溶液并加热:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-离子恰好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.NH4HCO3溶液与过量HCl溶液混合:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
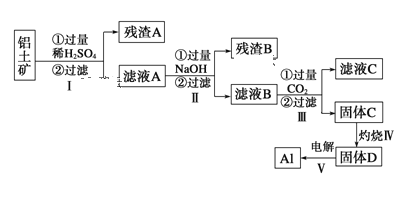
(1)滤液A加过量NaOH离子方程式表示为______________________________
(2)灼烧时盛放药品的仪器名称是_______
(3)步骤Ⅳ中发生反应的化学方程式是___________________________________
(4)步骤Ⅲ中生成固体C的离子反应方程式为_____________________________
(5)取滤液B 100mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7g,则滤液B中c(AlO2-)____mol/L,c(Na+)____6.5 mol/L (填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com