
 则合成涤纶树脂所需要单体的结构简式为
则合成涤纶树脂所需要单体的结构简式为
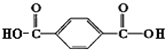 、HO-CH2CH2OH;
、HO-CH2CH2OH; 单体为
单体为 、HO-CH2CH2OH,
、HO-CH2CH2OH, ;HO-CH2CH2OH;
;HO-CH2CH2OH; 含有氨基和酯基,其中氨基显碱性,酯基呈中性;
含有氨基和酯基,其中氨基显碱性,酯基呈中性; 含有硝基,呈中性;
含有硝基,呈中性;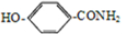 含有酚羟基,呈酸性,-CONH2呈中性,既有酸性又有碱性物质,应含有氨基和羧基,应为
含有酚羟基,呈酸性,-CONH2呈中性,既有酸性又有碱性物质,应含有氨基和羧基,应为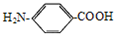 ,
, ;
;

 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )| A、元素X、Y的第一电离能:X<Y |
| B、简单离子半径:W>Q>Y>X |
| C、元素X的简单氢化物的空间构型为三角锥形 |
| D、元素W、Q的电负性:W>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 | 银氨溶液 | 新Cu(OH)2 | 金属钠 | |
| A | 中和反应 | -- | 溶解 | 产生氢气 |
| B | -- | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有红色沉淀 | -- |
| D | 水解反应 | -- | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学键 | ①-① | ①-④ | ④-④ | ④=④ | ④≡④ |
| 键能/kJ?mol-1 | 436.0 | 390.8 | 193 | 418 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | |
| ③用H2O2分解制O2时,加入MnO2 | |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g NO2含有氧原子数为2NA |
| B、常温常压下,22.4L N2含有的分子数为NA |
| C、1L 1mol?L-1 Al2(SO4)3溶液中含SO42-数目为NA |
| D、1mol Fe在足量Cl2中燃烧,转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com