
【题目】丙烯通入溴水中发生的化学反应方程式_______________________________________。实验室制取乙烯的化学反应方程式_____________________________________。
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Z、Y、P的原子序数逐渐增大。四种元素形成的化合物结构如图所示,其中各原子的核外电子排布均处于稳定结构。且X与Z、Y、P均可形成电子数相等的分子,X2P常温常压下为液体。下列说法不正确的是( )
![]()
A.X和P形成的化合物中可能存在非极性共价键
B.Z、Y、P的非金属性和最高价氧化物对应水化物的酸性都逐渐增强
C.Y的氢化物能和它的最高价氧化物对应水化物反应生成盐
D.X形成的简单离子半径不一定比Li+小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】埋在地下的钢管道可以用如图所示方法进行电化学保护,下列说法正确的是( )
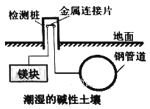
A.钢管道表面发生了还原反应
B.该方法将电能转化为了化学能
C.该方法称为外加电流阴极保护法
D.镁块上发生的电极反应:O2+2H2O+4e→4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】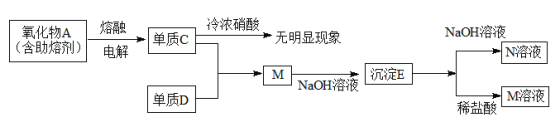
(1)M的化学式是AlCl3,用离子方程式表示其水溶液的酸碱性情况______________。
(2)元素C在周期表中的位置是第三周期第ⅢA族,其最高价氧化物对应的水化物的电离方程式是____________________。
(3)写出E与NaOH溶液反应的离子方程式________________________。
(4)单质C遇冷浓硝酸无明显现象的原因是______________________。
(5)电解熔融态氧化物A时,阳极发生的电极反应是___________________;没有发现熔剂之前,由于氧化物A熔点高,难以实现工业化过程,从物质结构角度说明A具有高熔点的原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.20 mol/L的盐酸和物质的量浓度为c mol/L的NaOH溶液按不同体积比配制成两种溶液。下表是配制时所取盐酸与 NaOH 溶液体积与混合后溶液中Na+与Cl-的物质的量浓度数据(忽略溶液体积变化):
溶液 | 混合前所取溶液体积(mL) | 混合后离子浓度(mol/L) | ||
HCl | NaOH | Na+ | Cl- | |
① | 30 | x | 1.5z | z |
② | 10 | y | z | 2z |
下列说法正确( )
A.x=90B.y=30C.z=0.10D.c=0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质变化的化学用语正确的是( )
A.氯化铝与氨水反应的离子方程式:Al3++3OH-=Al(OH)3↓
B.铁发生吸氧腐蚀的正极反应:O2+2H2O+4e=4OH-
C.碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
D.稀硫酸溶液中滴加少量氢氧化钡溶液:H++SO42++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题。
(1)含碳量在0.03%2%之间某合金,是目前使用量最大的合金,这种合金是___。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为___。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是__(填字母),大量增加的离子有___(填化学式)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)4Fe(NO3)2的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)2晶体的方法如图:
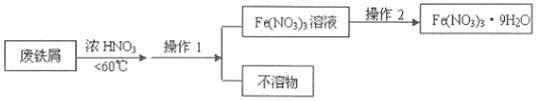
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为___。
②磁性氧化铁的化学式为___,试写出Fe2O3与硝酸反应的离子方程式___。
③操作1的名称为___,操作2的步骤为:___、___,过滤洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决燃料危机和温室效应,科学家尝试用CO2与CH4制取CO和H2。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(1) ΔH2=-128.3kJ·mol-1
CH3OH(1) ΔH2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
④2CH4(g)+O2(g)![]() 2CH3OH(1) △H4
2CH3OH(1) △H4
在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇在低温下能否自发进行____(填“能”或“否”),理由是____。
(2)某温度下,CH4(g)+H2O(g)![]() CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
一定条件下,按不同的投料比![]() 向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1____X2(填“>”或“<”,后同),Q____0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-)∶c(HCO3-)=____。
[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
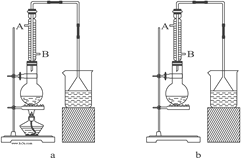
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com