
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
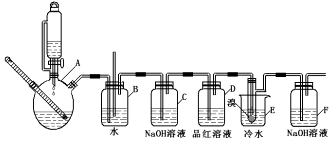
分析 实验室制备1,2-二溴乙烷流程:装置A中:乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{170℃}$CH2=CH2↑+H2O,全瓶b可以防止倒吸;当c堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化硫发生反应,除去乙烯中带出的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中:乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用F吸收,据此分析作答.
解答 解:(1)由题可知140℃时有副产品乙醚的生成,为了减少副产物乙醚生成,实验中应迅速将温度升高到170℃;
故答案为:减少副产物乙醚生成;
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下,所以气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下;
故答案为:使连通滴液漏斗里的溶液容易滴下;
(3)如果E中发生堵塞,B中压强增大,长直玻璃管中液面会上升;
故答案为:B中长直玻璃管内有一段液柱上升;
(4)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全;
故答案为:验证二氧化硫是否被除尽;
(5)挥发的溴蒸气,能够污染大气,需要进行尾气吸收,用氢氧化钠吸收;
故答案为:吸收挥发的溴蒸气;
(6)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发;由表中数据可知1,2-二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2-二溴乙烷会凝结为固体,从而导致导管堵塞;
故答案为:过渡冷却1,2-二溴乙烷易凝结成固体而发生堵塞;
(7)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发浓硫酸将部分乙醇氧化,乙烯流速过快,未完全发生加成反应;
故答案为:①浓硫酸将部分乙醇氧化②发生副反应生成乙醚③乙醇挥发④乙烯流速过快,未完全发生加成反应;
(8)在制取1,2一二溴乙烷的过程中还会有副产物乙醚生成;除去1,2一二溴乙烷中的乙醚,可以通过蒸馏的方法将二者分离,所以D正确;
故答案为:乙醚;D.
点评 本题考查了1,2-二溴乙烷实验室制取、乙烯的制取、实验装置的理解评价等,注意基础知识的掌握,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4→2H++SO42- | B. | NaHCO3→Na++HCO3- | ||
| C. | KClO3→K++Cl-+3O2- | D. | HAc?H++Ac- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| B. | 配制标准溶液的固体NaOH中混有杂质KOH | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-20Q kJ/mol | |
| B. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-40Q kJ/mol | |
| C. | $\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(g)△H=-20Q kJ/mol | |
| D. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-40Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.7g | B. | 16.1g | C. | 15.5g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com