
下列反应与Na2O2+SO2==Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2==2Na2CO3+O2↑ B.2Na2O2+2SO3==2Na2SO4+O2↑
C.Na2O2+H2SO4==Na2SO4+H2O2 D.3Na2O2+Cr2O3==2Na2CrO4+Na2O
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:实验题
(12分)某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案验证假设]该小组对燃烧后的白色产物进行如下探究:
实验 方案 | 实验操作 | 实验 现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是____________________。
(2)乙同学认为方案2得到的结论正确,白色物质为____________________。
(3)通过方案1和方案2的实验,你认为上述三个假设中,________成立。
(4)钠在二氧化碳中燃烧的化学方程式为__________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:______________、
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是:
A、过量的铁在氯气中燃烧可生成氯化亚铁
B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大
C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色
D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
A、B、C、D、E五种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍,A、E同一主族。下列说法正确的是
A.原子半径大小顺序为:E>D>C>B>A
B.A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物
C.B、C、D、E四种元素与A 元素形成的最简单化合物的沸点依次升高
D.D与A、E均可形成具有强氧化性的化合物,可用于城市自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol?L-1和1.5mol?L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:

回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
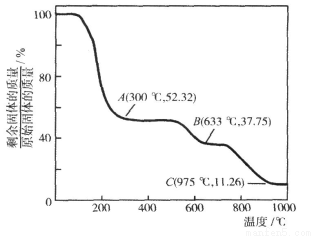
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:选择题
下列各项中离子方程式的书写与反应物的用量无关的是
A.AlCl3溶液与稀氨水 B.FeBr2溶液与Cl2
C.CO2与Na2SiO3溶液 D.澄清石灰水与Ca(HCO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作或结论正确的是
| A.制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,在加热的同时不断搅拌,直到得到红褐色溶液 |
| B.洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 |
| C.实验室配制950 mL 0.2 mol/L的CuSO4溶液时,需称取胆矾的质量为50 g |
| D.配液时,液面若超过刻度线,应用胶头滴管将多出液体吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com